
����Ŀ������������⣺
(1)10Be��9Be______________��
a����ͬһ��ԭ�ӡ�������b��������ͬ��������
c��������ͬ�Ļ�ѧ���� d��������ͬ�ĺ�������Ų�
(2)�������������ʣ�
��![]() O��
O��![]() O��
O��![]() O����H2O��D2O����ʯī�����ʯ ��H2��D2��T2����H��D��T����
O����H2O��D2O����ʯī�����ʯ ��H2��D2��T2����H��D��T����![]() K��
K��![]() Ca��
Ca��![]() Ar���ش��������⣺
Ar���ش��������⣺
a����Ϊͬλ�ص���______________��
b����Ϊͬ�����������______________��
c���ɢٺ͢��е����ܽ�ϳ�ˮ���ɵ�ˮ���ӵ�����Ϊ__________�֣��ɵ���Է���������ͬ��ˮ��������Ϊ__________�֣���Է�������������____________(д��ѧʽ)��
(3)![]() H2
H2![]() O��Ħ������Ϊ____________����ͬ������
O��Ħ������Ϊ____________����ͬ������![]() H2
H2![]() O��
O��![]() H2
H2![]() O����������֮��Ϊ______��������֮��Ϊ__________��
O����������֮��Ϊ______��������֮��Ϊ__________��
(4)�����ͬ������![]() H2
H2![]() O��
O��![]() H2
H2![]() Oʱ������������ͬ��ͬѹ�����֮��Ϊ__________������֮��Ϊ__________��
Oʱ������������ͬ��ͬѹ�����֮��Ϊ__________������֮��Ϊ__________��
���𰸡�cd �٢� �� 18 7 TO 20 g��mol��1 11��10 11��12 10��9 5��9
��������
��1��10Be��9Be��Ϊͬλ�أ����ǵ���������ͬ������������������ͬ������ͬһ��ԭ�ӣ��������Ƕ���BeԪ�ص�ԭ�ӣ���ѧ������ͬ��������ͬ�ĺ�������Ų�����ѡcd��
��2����![]() O��
O��![]() O��
O��![]() O������ԭ������������8����������ͬ�����Ƕ�����Ԫ�ص�ͬλ�أ�
O������ԭ������������8����������ͬ�����Ƕ�����Ԫ�ص�ͬλ�أ�
��H2O��D2O�����Dz���ԭ�ӣ�Ҳ���ǵ��ʣ�����ͬλ�ػ�ͬ����������о����룻
��ʯī�����ʯ����̼Ԫ�صĵ��ʣ���Ϊͬ�������壻
��H2��D2��T2�ֱ���![]() ��
��![]() ��
��![]() �γɵ��������ʣ����Dz���ԭ�ӣ�ȴ��ͬһ�����ʣ��������Dz���ͬλ�ػ�ͬ����������о����룻
�γɵ��������ʣ����Dz���ԭ�ӣ�ȴ��ͬһ�����ʣ��������Dz���ͬλ�ػ�ͬ����������о����룻
��H��D��T�ֱ���![]() ��
��![]() ��
��![]() �����ǵ�����������1����������ͬ�����Ƕ�����Ԫ�ص�ͬλ�أ�
�����ǵ�����������1����������ͬ�����Ƕ�����Ԫ�ص�ͬλ�أ�
��![]() K��
K��![]() Ca��
Ca��![]() Ar�����ǵ���������ͬ���ʱ˴˲���ͬλ�أ�
Ar�����ǵ���������ͬ���ʱ˴˲���ͬλ�أ�
��a����Ϊͬλ�ص��Ǣ٢ݣ�b����Ϊͬ����������Ǣۣ�
c���ɢ٣�![]() O��
O��![]() O��
O��![]() O���͢ݣ�H��D��T���е����ܽ�ϳ�ˮ������ˮ��������������ԭ�Ӻ�һ����ԭ�ӣ�����������ԭ�ӿ����Dz�ͬ����ģ�����ԭ�ӵġ����䡱��6�֣��ʿ��γ�ˮ���ӵ�����Ϊ18��=6��3���֣��ɵ���Է���������ͬ��ˮ��������Ϊ7�֣���Է��������ֱ���18��H216O����19��HD16O��H217O����20��D216O��HT16O��HD17O��H218O����21��DT16O��D217O��HT17O��HD18O����22��T216O��DT17O��D218O��HT18O����23��T217O��DT18O����24��T218O������Է�������������T218O��
O���͢ݣ�H��D��T���е����ܽ�ϳ�ˮ������ˮ��������������ԭ�Ӻ�һ����ԭ�ӣ�����������ԭ�ӿ����Dz�ͬ����ģ�����ԭ�ӵġ����䡱��6�֣��ʿ��γ�ˮ���ӵ�����Ϊ18��=6��3���֣��ɵ���Է���������ͬ��ˮ��������Ϊ7�֣���Է��������ֱ���18��H216O����19��HD16O��H217O����20��D216O��HT16O��HD17O��H218O����21��DT16O��D217O��HT17O��HD18O����22��T216O��DT17O��D218O��HT18O����23��T217O��DT18O����24��T218O������Է�������������T218O��
��3��![]() H2
H2![]() O��Ħ������Ϊ[(2��2)+16]g��mol-1=20g��mol-1��M(
O��Ħ������Ϊ[(2��2)+16]g��mol-1=20g��mol-1��M(![]() H2
H2![]() O)=22g��mol-1��1��
O)=22g��mol-1��1��![]() H216O���Ӻ�10�����Ӻ�10�����ӣ�1��
H216O���Ӻ�10�����Ӻ�10�����ӣ�1��![]() H218O���Ӻ�10�����Ӻ�12�����ӣ�����
H218O���Ӻ�10�����Ӻ�12�����ӣ�����![]() H216O��
H216O��![]() H218O����1g����1g��
H218O����1g����1g��![]() H216O��1g��
H216O��1g��![]() H218O����������Ϊ(
H218O����������Ϊ(![]() ):(
):(![]() )=11:10����������Ϊ(
)=11:10����������Ϊ(![]() ):(
):(![]() )=11:12��
)=11:12��
��4������![]() H2
H2![]() O��
O��![]() H2
H2![]() O����1g��M(
O����1g��M(![]() H2
H2![]() O)=18g��mol-1��M(
O)=18g��mol-1��M(![]() H2
H2![]() O)=20g��mol-1����n(
O)=20g��mol-1����n(![]() H2
H2![]() O)=
O)=![]() mol��n(
mol��n(![]() H2
H2![]() O)=
O)=![]() mol�������������n(
mol�������������n(![]() H2)=
H2)=![]() mol��n(
mol��n(![]() H2)=
H2)=![]() mol�����ݰ����ӵ����ɿ�֪������������ͬ��ͬѹ�µ����Ϊ
mol�����ݰ����ӵ����ɿ�֪������������ͬ��ͬѹ�µ����Ϊ![]() ��
��![]() =10��9��������Ϊ(
=10��9��������Ϊ(![]() ��2):(
��2):(![]() ��4)=5:9��
��4)=5:9��


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ���������ֵ������˵����ȷ���ǣ� ��
A.1mol����(-NO2)��46gNO2�����ĵ�������Ϊ23NA
B.1mol�������к��й��ۼ���Ϊ12NA
C.��FeI2��Һ��ͨ������Cl2������1molFe2+������ʱ��ת�Ƶĵ�����ΪNA
D.��⾫��ͭʱ����ת����NA�����ӣ�������������С32g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��ȷ����( )
A.���ɫ����![]() ȫ����������
ȫ����������![]()
B.ˮ��������![]() ��Һ�У�
��Һ�У�![]()
C.����Ũ�ȵ�![]() ��Һ��
��Һ��![]() Һ�������2:3��ϣ�
Һ�������2:3��ϣ�![]()
D.�����(��![]() )��84����Һ��Ϻ����������
)��84����Һ��Ϻ����������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ��ʾ���淴ӦA(s)+B(g) n C(g)����H=Q kJ��mol1���ڲ�ͬ�����·�Ӧ�������C�İٷֺ����ͷ�Ӧ��������ʱ��Ĺ�ϵ���ߡ������й�������һ����ȷ��
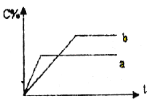
A. ������Ϊ��������a��ʾ�д�����b��ʾû�д���
B. ֻ�ı��¶ȣ���a��b���¶ȸߣ���Q>0
C. ֻ�ı�ѹǿ����a��b��ѹǿ��n>2
D. ��ͼ����������жϣ���Ӧһ��������Ӧ����ʼ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������N2O5�����η����ķֽⷴӦ:��N2O5(g)![]() N2O3(g)+O2(g)����N2O3(g)
N2O3(g)+O2(g)����N2O3(g)![]() N2O(g)+O2(g)�������Ϊ2L�ܱ������г���8molN2O5�����ȵ�t�����ﵽƽ��״̬����ʱO2Ϊ9mol�� N2O3Ϊ3.4mol����t��ʱ��Ӧ�ٵ�ƽ�ⳣ��Ϊ
N2O(g)+O2(g)�������Ϊ2L�ܱ������г���8molN2O5�����ȵ�t�����ﵽƽ��״̬����ʱO2Ϊ9mol�� N2O3Ϊ3.4mol����t��ʱ��Ӧ�ٵ�ƽ�ⳣ��Ϊ
A. 10.7 B. 8.5 C. 9.6 D. 10.2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.���ü������ԭNOx���������������Ⱦ
��CH4(g)��4NO2(g)![]() 4NO(g)��CO2(g)��2H2O(g) ��H1����574kJ��mol��1
4NO(g)��CO2(g)��2H2O(g) ��H1����574kJ��mol��1
��CH4(g)��4NO(g)![]() 2N2(g)��CO2(g)��2H2O(g) ��H2����1 160kJ��mol��1
2N2(g)��CO2(g)��2H2O(g) ��H2����1 160kJ��mol��1
��CH4(g)��2NO2(g)![]() N2(g)��CO2(g)��2H2O(g) ��H3����867kJ��mol��1
N2(g)��CO2(g)��2H2O(g) ��H3����867kJ��mol��1
��1�����������Ӧ��ƽ�ⳣ������ΪK1��K2��K3����K3��___(��K1��K2��ʾ)��
��2����2L�����ܱ������г���1molCH4��2molNO2���з�Ӧ�ۣ�CH4��ƽ��ת������(CH4)���¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
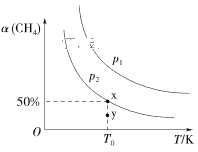
���������е�ѹǿΪp2��y�㣺v��____(����������������������С����)v�档
��x���Ӧ�¶��·�Ӧ��ƽ�ⳣ��K��___��
��.��������ת������H2����Ҫ��ӦΪ��CH4(g)��H2O(g)![]() CO(g)��3H2(g)
CO(g)��3H2(g)
��3���ں����ܱ������г���2 mol CH4��H2O(g)�Ļ�����壬��CH4��H2O(g)�����ʵ���֮��Ϊx����ͬ�¶��´ﵽƽ��ʱ���H2�����������(H2)��x�Ĺ�ϵ��ͼ��ʾ��
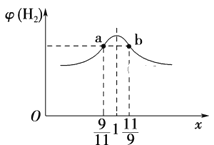
��CH4��ת���ʣ�a��____(����>������������<������ͬ)b�㣬CH4(g)��Ũ�ȣ�a��_____b�㣬�����IJ��ʣ�a��____b�㡣
��.��4���������������Ȼ�ѧ����ʽ��2H2S(g)+3O2(g)=SO2(g) +2H2O(l) ��H=-Q1kJ��mol-1��2H2S(g)+O2(g)= S(s)+2H2O(l) ��H=-Q2kJ��mol-1��2H2S(g)+O2(g)= S(s)+2H2O(g) ��H=-Q3kJ��mol-1���ж�Q1��Q2��Q3�Ĵ�С��ϵ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ���������800��ʱ��Ӧ2NO(g)��O2(g) ![]() 2NO2(g)��ϵ����n(NO)��ʱ��ı仯���±���
2NO2(g)��ϵ����n(NO)��ʱ��ı仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K��__________��
��2��0��2 s�ڸ÷�Ӧ��ƽ������v(NO)��__________, v(O2)��__________��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����__________��
a��v(NO2)��2v(O2)
b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2)
d���������ܶȱ��ֲ���
��4����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����__________��
a����ʱ�����NO2���塡�� b������O2��Ũ��
c������������� d��ѡ���Ч����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ϊ����һ�������������仯�������������й㷺Ӧ�á��ش��������⣺
(1)��̬Fe3+�ĵ����Ų�ʽΪ________��
(2)ʵ������KSCN��Һ������(![]() )����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ_______(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ______��
)����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ_______(��Ԫ�ط��ű�ʾ)��������̼ԭ�ӵ��ӻ��������Ϊ______��
(3)FeCl3���۵�Ϊ306�棬�е�Ϊ315�� FeCl3�ľ���������______��FeSO4������������SO42-�����幹����_______��
(4)�ʻ���[Fe(CO)5]���������������Ϳ������ȣ�1 mol Fe(CO)5�����к�������ĿΪ_______����CO��Ϊ�ȵ������������__________(�ѧʽ��дһ��)
(5)����������ľ���ṹʾ��ͼ��ͼ��ʾ���þ�������������������֮��Ϊ______��
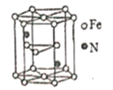
(6)������������ľ�����ͼ��ʾ����֪����������������ܶ�Ϊ��g��cm-1��NA���������ӵ�������ֵ���ڸþ����У���Fe2+�����ҵȾ����Fe2+��ĿΪ_____��Fe2+��O2-����̼��Ϊ_______ pm��
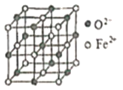
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��R��X��Y��Z������Ԫ��,�䳣�����ϼ۾�Ϊ+2��,��X2+�뵥��R����Ӧ,X2++Z=X+Z2+,Y+Z2+=Y2++Z�����������ӱ���ԭ��0��ʱ,���ֵ�������ǿ��˳��Ϊ( )
A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com