
在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中: ①为氯气发生装置;②的试管里盛有15mL 30% KOH 溶液.并置于热水浴中; ③的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④的试管里加有紫色石蕊试液; ⑤为尾气吸收装置。
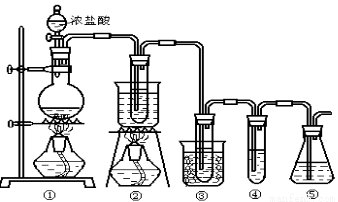
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
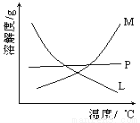
(2)比较制取氯酸钾和次氯酸钠的条件.二者的差异是 。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是: 。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象 | 原因 |
溶液最初从紫色逐渐变为 色 |
氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 |
______________________________________ |
然后溶液从无色逐渐变为 色 |
_________________________________________ |
(1)分液漏斗 B (2)反应物浓度不同,反应温度不同 M 过滤
(3)Cl2+OH-=ClO-+Cl-+H2O
(4)
实验现象 | 原因 |
溶液最初从紫色逐渐变为 红 色 |
氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 |
氯气与水反应生成次氯酸,次氯酸具有强氧化性,可以把石蕊氧化为无色 |
然后溶液从无色逐渐变为 黄绿色 色 |
继续通入的氯气溶于水形成氯水,呈黄绿色溶液 |
【解析】
试题分析:⑴制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗主要是方便控制反应的起始和终止。氯气在饱和食盐水中的溶解度比较小,氯化氢的比较大,因此可以选用饱和食盐水来吸收氯化氢。比较制取氯酸钾和次氯酸钠的条件.二者的差异是反应物浓度不同,反应温度不同。氯酸钾和次氯酸钠的溶解度随温度的升高二增大,因此符合该晶体溶解度曲线的是M。制备次氯酸盐一般选择氯气与相应的碱反应制备,因此Cl2+OH-=ClO-+Cl-+H2O。溶液最初从紫色逐渐变为红色主要是因为氯气与水反应生成的H+使石蕊变色。随后溶液逐渐变为无色主要是氯气与水反应生成次氯酸,次氯酸具有强氧化性,可以把石蕊氧化为无色然后溶液从无色逐渐变为黄绿色,主要是由于继续通入的氯气溶于水形成氯水,呈黄绿色溶液。
考点:考查氯的重要化合物的相关知识点。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源:2013-2014浙江省高一下学期期中化学试卷(解析版) 题型:选择题
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能为 ( )
A.X+32 B.X+4 C.X+8 D.X+18
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高三高考模拟理综化学试卷(解析版) 题型:选择题
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是

A.该图体现出原子核外电子层呈现周期性变化
B.原子半径:W>R>X
C.W的氢化物与R的氢化物水溶液的酸性比较,前者强于后者,可证明非金属性:R>W
D.R、Z形成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
乙酸和乙醇在浓硫酸存在的条件下发生反应,生成的有机物的相对分子质量是88。今有分子量比乙醇大16的有机物和乙酸在相似的条件下发生类似的反应,生成的有机物的相对分子质量为146,下列叙述正确的是
A.是丙三醇和乙酸发生了酯化反应 B.生成的有机物是乙酸丙酯
C.分子量为146的有机物可以发生水解反应 D.发生的反应属消去反应
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是

图1 图2 图3 图4
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。请根据图像推断,下列说法中不正确的是(已知HCO3-与AlO2-在溶液中不能共存)
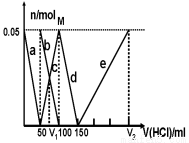
A.M点时生成的CO2为0 mol
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2
C.V1:V2=1:4
D.a段表示的离子方程式为:AlO2- +H+ + H2O=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
A.合金的熔点一般比组分金属低
B.铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出
D.若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省宁波市高二下学期期末考试化学试卷(解析版) 题型:选择题
下列与有机物结构、性质相关的叙述错误的是 ( )
A.乙醛和丙烯醛(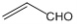 )不是同系物,但它们与H2充分反应后的产物是同系物
)不是同系物,但它们与H2充分反应后的产物是同系物
B.一分子β-月桂烯( )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种
)与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种
C.用甘氨酸(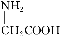 )和丙氨酸(
)和丙氨酸( )缩合最多可形成4种二肽
)缩合最多可形成4种二肽
D. 和
和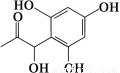 都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同
都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省台州市路桥区高考理综化学模拟试卷二试卷(解析版) 题型:实验题
三氯化六氨合钴(Ⅲ)是一种重要的化工产品, 实验中采用H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂将Co(Ⅱ)氧化为Co(Ⅲ),来制备三氯化六氨合钴(Ⅲ)配合物,反应式为:2CoCl2·6H2O + 10NH3 + 2NH4Cl + H2O2 活性炭2[Co(NH3)6]Cl3 +14H2O
已知:① 钴(Ⅱ)与氯化铵和氨水作用,经氧化后一般可生成三种产物:紫红色的二氯化一氯五氨合钴[Co(NH3)5 Cl]Cl2晶体、砖红色的三氯化五氨一水合钴[Co(NH3)5 H2O]Cl3晶体、橙黄色的三氯化六氨合钴[Co(NH3)6]Cl3晶体,控制不同的条件可得不同的产物(如温度不同产物也不同)。293K时,[Co(NH3)6]Cl3在水中的溶解度为0.26mol/L
②CoCl2、[Co(NH3)6]Cl3、[Co(NH3)5 Cl]Cl2在水中能完全电离
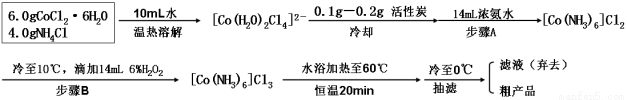
③制备三氯化六氨合钴(Ⅲ)粗产品的流程如下:
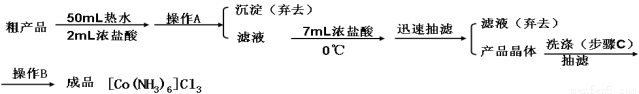
④三氯化六氨合钴(Ⅲ)粗产品的提纯流程如下:
⑤制备过程中可能用到的部分装置如下:
请回答下列问题:
(1)操作B的名称是 ,操作A后所弃去的沉淀中一定有 。
(2)CoCl2在没有铵盐存在的情况下,遇氨水生成蓝色沉淀,该反应的离子方程式为 。原料NH4Cl的主要作用有:① ;②提供NH3。
(3)冷却至10℃后,步骤B中逐滴加入H2O2溶液的目的:① ;②使反应温和进行。
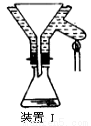
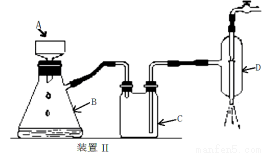
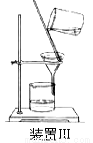
(4)操作A的名称为 ,进行该操作的装置是 (填序号)。
A.装置Ⅰ B.装置Ⅱ C.装置Ⅲ
若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是 。
装置Ⅱ中仪器A、B、C、D的名称分别是 、 、 、 。
(5)步骤C进行洗涤时要用到两种试剂,应该先用_____(填序号,下同)洗涤,后用 洗涤。
A. 饱和氯化钠溶液 B. 无水乙醇 C. 浓盐酸
(6)你认为本实验提高产率的关键步骤有哪些? 。
(7)与[Co(NH3)6]Cl3类似的产品还有[Co(NH3)5Cl]Cl2,请简述验证某晶体是[Co(NH3)6]Cl3 还是
[Co(NH3)5Cl]Cl2的实验方案: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com