
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 标准状况下,2.24LSO3中含有0.1NA个SO3分子
B. 向1L的密闭容器中充入46gNO2气体,容器中气体的分子数为NA
C. 常温下,将2.7g铝片投入足量的浓硫酸中,转移电子的数目为0.3NA
D. ![]() 的同分异构体中含有苯环且属于羧酸的有14种
的同分异构体中含有苯环且属于羧酸的有14种
【答案】D
【解析】A. 根据标准状况下,SO3不是气体分析;B. 根据NO2中存在平衡:2NO2N2O4分析;C. 根据常温下,铝与浓硫酸发生钝化分析;D. ![]() 的同分异构体中含有苯环且属于羧酸的结构中一定含有羧基、苯环,其余2个碳原子分情况书写分析判断。
的同分异构体中含有苯环且属于羧酸的结构中一定含有羧基、苯环,其余2个碳原子分情况书写分析判断。
A. 标准状况下,SO3不是气体,无法用n=![]() 计算2.24LSO3的物质的量,故A错误;B、NO2中存在平衡:2NO2N2O4,导致分子个数减小,则容器中气体分子个数小于NA个,故B错误;C. 常温下,铝与浓硫酸发生钝化,2.7g铝不能完全反应,故C错误;D.
计算2.24LSO3的物质的量,故A错误;B、NO2中存在平衡:2NO2N2O4,导致分子个数减小,则容器中气体分子个数小于NA个,故B错误;C. 常温下,铝与浓硫酸发生钝化,2.7g铝不能完全反应,故C错误;D.![]() 的同分异构体中含有苯环且属于羧酸的有:①羧基直接与苯环连接,剩余两个碳作为乙基存在邻、间、对3种同分异构体,作为两个甲基存在6种同分异构体;②骨架为苯乙酸,甲基存在邻、间、对3种同分异构体;③苯丙酸有2种,共14种同分异构体,故D正确;故选D。
的同分异构体中含有苯环且属于羧酸的有:①羧基直接与苯环连接,剩余两个碳作为乙基存在邻、间、对3种同分异构体,作为两个甲基存在6种同分异构体;②骨架为苯乙酸,甲基存在邻、间、对3种同分异构体;③苯丙酸有2种,共14种同分异构体,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】实验室可用下列几组试剂制取少量NH3:
①固体Ca(OH)2和NH4Cl;②浓氨水和固体CaO;③浓氨水。
请回答下列问题:
(1)用上述三组试剂制取少量NH3,需要加热的是________(填序号),第①组试剂中产生NH3的化学方程式可表示为____________________________________。
(2)下面的制取装置图中,方法①应选用装置________(填“A”或“B”,下同),方法②应选用装置________。
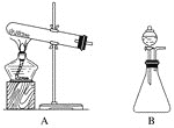
(3)在制取后,如果要干燥氨气,应选用的干燥剂是________(填字母)。
A.浓硫酸 B.固体氢氧化钠 C.五氧化二磷
D.碱石灰 E.固体CaO F.无水CaCl2
(4)检验集气瓶中是否收集满氨气的方法是__________________________________。
(5)为防止环境污染,如下装置(盛放的液体为水)可用于吸收多余NH3的是________(填序号)。
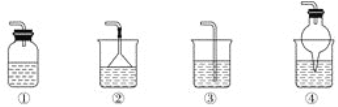
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种物质存在如图所示的转化关系(图中“→”表示一步转化)。下列各组物质中,不能满足此转化关系的是( )
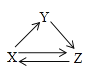
物质 选项 | X | Y | Z |
A | Al | Al2O3 | NaAlO2 |
B | Fe | FeCl3 | FeCl2 |
C | C | CO | CO2 |
D | Cl2 | HCl | NaCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是有机合成中的重要原料。实验室制备溴乙烷(C2H5Br,沸点38.4℃)的装置如图所示,其实验步骤为:①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;②向仪器a中加入10mL 95%乙醇、28mL 92%浓硫酸,然后加入适量溴化钠和几粒碎瓷片;③在45~50℃加热2h,使其充分反应。回答下列问题:
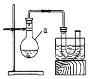
(1)仪器a的名称是________。
(2)在大烧杯中加入冰水的目的是________。
(3)加入碎瓷片的作用是________。
(4)为了更好的控制温度,选择常用的加热方式为________。
(5)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为________,生成的无色刺激性气味气体的分子式为________。
(6)U形管内可观察到的现象是_____________。
(7)反应结束后,U形管内粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可以选择下列试剂中的________(填序号)。
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.苯
(8)检验溴乙烷中溴元素的实验步骤是:取少量溴乙烷于试管中,加入NaOH溶液,加热煮沸一段时间,冷却,________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1molHH键、1mol II键、1molHI键分别需要吸收的能量为436kJ、151kJ、299k J.则由氢气和碘反应生成1mol HI需要______(填“放出”或“吸收”)______kJ的热量.氢气、碘和碘化氢三种分子最稳定的是______(填化学式)
(2)C、![]() 是常用的燃料,它们每1mol分别完全燃烧生成
是常用的燃料,它们每1mol分别完全燃烧生成![]() 及
及![]() 时,放出的热量分别为
时,放出的热量分别为![]() 、
、![]() 。计算说明:
。计算说明:![]() 有数值计算的题,数值结果保留到小数点后1位。
有数值计算的题,数值结果保留到小数点后1位。![]()
![]() 完全燃烧时放出的热量?_________
完全燃烧时放出的热量?_________
![]() 完全燃烧相同质量的C和
完全燃烧相同质量的C和![]() ,哪种燃料放出热量较多?_________
,哪种燃料放出热量较多?_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述中正确的是( )
A. 92gNO2和N2O4混合气体中含有的原子数为3NA
B. 71g氯气与足量铁粉充分反应,转移的电子数为3 NA
C. 0.5mol·L-1的Ba(OH)2溶液中OH-的数目为NA
D. 1 mol Mg与足量的O2或N2反应生成MgO或Mg3N2时,失去的电子数均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 向NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
B. Cu溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O
C. 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D. 氯气溶于水:Cl2+H2O=H++Cl-+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,氯化法是合成硫酰氯(SO2Cl2)的常用方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出):

已知:① SO2(g) + Cl2(g)=SO2Cl2(l) ΔH=-97.3 kJ/mol。②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1)装置A中发生反应的离子方程式为_________________________________。
(2)装置B中的除杂试剂为___________________(填名称),若缺少装置C,会导致装置D中SO2与Cl2还可能发生反应的化学方程式为_________________________。
(3)仪器D的名称为__________________,E中冷凝水的的出口是____________(填“a”或“b”),F的作用除了防止空气中水蒸气进入D装置内之外,还可以__________________________________。
(4)当装置A中排出氯气1.12 L(已折算成标准状况)时,最终得到4.05g纯净的硫酰氯,则硫酰氯的产率为___________。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
①加热三颈烧瓶 ②控制气流速率,宜慢不宜快 ③若三颈烧瓶发烫,可适当降温 ④先通冷凝水,再通气
(5)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2 + H2SO4,分离产物的方法是________。
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | b极有气体产生 c极无变化 | d极溶解 c极有气体产生 | 电流计指示在导线中 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A. d>a>c>bB. b>c>d>aC. d>a>b>cD. a>b>d>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com