
【题目】实验室制备下列气体时,只能用排水法收集的气体是( )
A. H2 B. NO C. NO2 D. CO2
科目:高中化学 来源: 题型:
【题目】下列关于氯水的说法正确的是( )
A. 新制氯水含有Cl2、HCl、HClO、H2O分子
B. 紫色石蕊试剂滴入新制氯水中,溶液先变红后变无色
C. 氯水和液氯都能使干燥的有色布条褪色
D. 新制氯水的pH值要比久置氯水的pH值小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧族元素和卤族元素都能形成多种物质,我们可以利用所学物质结构的相关知识去认识和理解。
(1)H+可与H2O形成H3O+,H3O+ 立体构型为_________。H3O+中H﹣O﹣H键角比H2O中H﹣O﹣H键角大,原因为_________________________________________。
(2)COCl2的空间构型为____________;溴的价电子排布式为________________。
(3)根据已经掌握的共价键知识判断,键的极性F-H _______ O-H(“>”,“=”或“<”)
(4)溴化碘和水反应生成了一种三原子分子,该分子的结构式为____________________ ,中心原子杂化轨道类型为________________。
(5)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是________。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(6)下列分子既不存在sp σ键,也不存在pp π键的是________。
A.HCl B.HF C.SO2 D.SCl2
(7)ClO2-立体构型为____________,写出与ClO2-互为等电子体的一种分子为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句。下列说法不正确的是
A. 蚕丝的主要成分是蛋白质B. 蚕丝属于天然高分子材料
C. “蜡炬成灰”过程中发生了氧化反应D. “泪”是油酯,属于高分子聚合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拟用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。下列可以得到干燥纯净的气体的选项是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO3溶液 | 浓硫酸 |
B | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
C | Cl2 | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 浓硫酸 |
D | NO2 | 浓硝酸 | 铜屑 | H2O | 固体NaOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己二酸( )是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
)是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
![]() 8NO↑+7H2O
8NO↑+7H2O

可能用到的有关数据如下:
物质 | 密度(20 ℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
环己醇 | 0.962 g·cm-3 | 25.9 ℃ | 160.8 ℃ | 20 ℃ 时水中溶解度 3.6 g,可混溶于乙醇、苯 | 100 |
己二酸 | 1.36 g·cm-3 | 152 ℃ | 337.5 ℃ | 在水中的溶解度:15 ℃ 时1.44 g,25 ℃ 时 2.3 g,易溶于乙醇,不溶于苯 | 146 |
实验步骤如下:Ⅰ.在三口烧瓶中加入 16 mL 50%的硝酸(密度为 1.31 g·cm-3),再加入1~2粒沸石,滴液漏斗中盛放有 5.4 mL 环己醇。Ⅱ.水浴加热三口烧瓶至 50 ℃ 左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60~65 ℃ 之间。Ⅲ.当环己醇全部加入后,将混合物用80~90 ℃ 水浴加热约 10 min(注意控制温度),直至无红棕色气体生成为止。Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。Ⅴ.粗产品经提纯后称重为 5.7 g。
请回答下列问题:
(1)仪器b的名称为___________________________________________________。
(2)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则,可能造成较严重的后果,试列举一条可能产生的后果:_______________________。
(3)已知用NaOH溶液吸收尾气时发生的相关反应方程式为2NO2+2NaOH===NaNO2+NaNO3+H2O,NO+NO2+2NaOH===2NaNO2+H2O。如果改用纯碱溶液,吸收尾气时也能发生类似反应,则相关反应方程式为________ 、_____________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和________洗涤晶体。
(5)粗产品可用________ 法提纯(填实验操作名称)。本实验所得到的己二酸产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙(由6个球体所围成的空隙。6个球体中心的连线连接成八面体形状),一种由镍原子构成,另一种由镍原子和镁原子一起构成,两种八面体的数量比是1︰3,碳原子只填充在镍原子构成的八面体空隙中。
(1)镍的外围电子排布式为________________。
(2)画出该新型超导材料的一个晶胞。(镁原子处于晶胞的顶点。碳原子用▲球,镍原子用○球表示)_______。
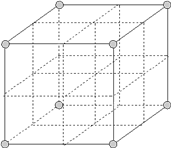
(3)写出该新型超导材料的化学式_____________。
(4)镍原子的配位数是_____________。
(5)原子坐标参数表示晶胞内部各原子的相对位置,用(0,0,0)表示镁原子的原子坐标,晶胞边长设为1,则碳原子的原子坐标参数为_____________。
(6)已知晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,阿伏加德罗常数的数值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的NaHCO3和Na2O2的混合物置于一密闭容器中充分加热,反应中转移的电子数为1mol,下列说法一定正确的是( )
A. 混合物中NaHCO3和Na2O2物质的量一定相等
B. 容器中肯定有0.5molO2
C. 反应后,容器中的固体只有Na2CO3
D. 反应后,容器中一定没有H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com