
| A、在自然界中既有化合态又有游离态 |
| B、单质常用作半导体材料 |
| C、气态氢化物很稳定 |
| D、最高价氧化物不与任何酸反应,可制光导纤维 |


科目:高中化学 来源: 题型:
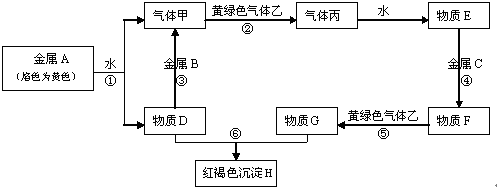
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将碘水倒入分液漏斗,加适量乙醇,震荡后静置,能将碘萃取到乙醇中 |
| B、用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性 |
| C、向某溶液中加入K3[Fe(CN)6]溶液,生成特征蓝色的沉淀,原溶液中含有Fe2+ |
| D、在含有FeCl2杂质的FeCl3溶液中通入足量的Cl2后,充分加热蒸干,可得到纯净的FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol N2所含有的原子数为NA |
| B、标准状况下,22.4 L水中含有的水分子数为NA |
| C、标准状况下,22.4 L氯化氢所含的原子数为NA |
| D、32 g O2所含的氧原子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2是氧化剂,反应中Cl原子得到电子 |
| B、当1molCl2完全反应时,有2mol电子发生转移 |
| C、NaBr是还原剂,反应中溴离子得到电子 |
| D、当1molNaBr完全反应时,有1mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫黄是一种易溶于水的黄色晶体 |
| B、SO2的水溶液显酸性 |
| C、SO2是黄色易溶于水的有毒气体 |
| D、SO2不稳定,极易转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com