
| A.红棕色的NO2气体加压后颜色先变深再变浅 |
| B.H2、I2、HI混合气体加压后颜色变深 |
| C.二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 |
| D.打开汽水瓶,看到有大量的气泡逸出 |
科目:高中化学 来源:不详 题型:单选题
| A.绝对不溶解的物质是不存在的 |
| B.不溶于水的物质溶解度为0 |
| C.物质的溶解性为难溶,则该物质不溶于水 |
| D.某离子被沉淀完全是指该离子在溶液中的浓度为0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.温度一定时,Ksp(SrSO4)随c(SO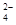 )的增大而减小 )的增大而减小 |
| B.三个不同温度中,313 K时Ksp(SrSO4)最大 |
| C.283 K时,图中a点对应的溶液是饱和溶液 |
| D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgCl=AgI=Ag2S | B.AgCl<AgI<Ag2S |
| C.AgCl>AgI>Ag2S | D.AgI>AgCl>Ag2S |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.pH=3时溶液中铁元素的主要存在形式是Fe3+ |
| B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去 |
| C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右 |
| D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
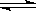 F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol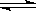 H2O(l) △H=-57.3kJ/mol
H2O(l) △H=-57.3kJ/mol| A.当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发) |
B.水电离的热化学方程式为:H2O(1) 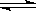 H+(aq)+OH—(aq);△H= +57.3kJ/mol H+(aq)+OH—(aq);△H= +57.3kJ/mol |
| C.当c > 0.1时,一定不存在:c(Na+) = c(F—) |
| D.若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 酸或碱 | 电离平衡常数(Ka或 Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
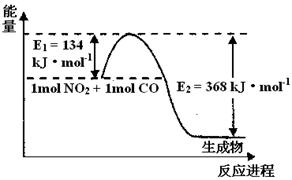
 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表:请完成下列问题。| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.5×10-16 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25℃时,0.1 mol·L-1HF溶液中pH=1 | B.该体系中有CaF2沉淀产生 |
C.该体系中KSP(CaF2)=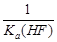 | D.KSP(CaF2)随温度和浓度的变化而变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com