
| 250 |
| 25 |
| 80m(V2-V1)×10-2g |
| Wg |
| 0.8m(V2-V1) |
| W |
| 0.8m(V2-V1) |
| W |


科目:高中化学 来源: 题型:
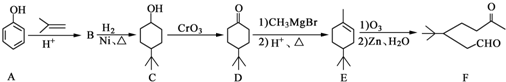
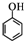 )和CH2=CH2为原料制备有机物
)和CH2=CH2为原料制备有机物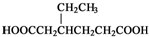 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol过氧化钠与水反应转移电子数为NA |
| B、0.1mol氯化铁水解制成胶体,所得胶体粒子数为0.1NA |
| C、标准状况下,22.4L水中含有水分子数为NA |
| D、1L 0.1mol每升乙酸溶液中氢离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
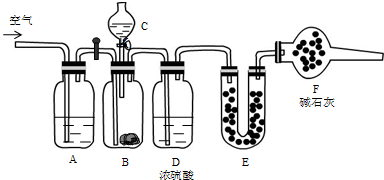
查看答案和解析>>
科目:高中化学 来源: 题型:
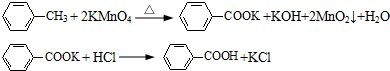
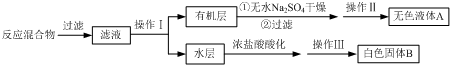

查看答案和解析>>
科目:高中化学 来源: 题型:
| 氯气 |
| ① |
| 一定条件 |
| ② |
| 高温、高压、催化剂 |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
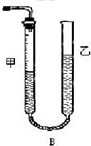 为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案.请回答每个方案中提出的问题.
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案.请回答每个方案中提出的问题.| V |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定序号 | 盐酸溶液的体积/mL | 氢氧化钠溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 15.52 |
| 2 | 25.00 | 1.20 | 16.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主 食 | 米 饭 |
| 副 食 | 红烧鱼 |
| 饮 品 | 豆 浆 |
| 你的补充 | ? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com