
【题目】以下反应均可生成![]() 。下列有关说法正确的是
。下列有关说法正确的是![]()
![]() 二氧化碳分解生成氧气:
二氧化碳分解生成氧气:![]() ;
;![]()
![]() 过氧化氢分解生成氧气:
过氧化氢分解生成氧气:![]() ;
;![]()
![]() 光照条件下,催化分解水蒸气生成氧气:
光照条件下,催化分解水蒸气生成氧气:![]() ;
;![]() 。
。
A.反应![]() 使用催化剂,能降低该反应的活化能
使用催化剂,能降低该反应的活化能
B.反应![]() 为吸热反应
为吸热反应
C.反应![]() 将化学能转化为光能
将化学能转化为光能
D.反应![]() ;
;![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度时,向容积为 2 L 的密闭容器中充入一定量的 SO2(g)和 O2(g),发生反应:2SO2(g)+ O2(g)2SO3(g) △H = - 196 kJ/mol。一段时间后反应达到平衡状态,反应过程中测定的部分数据如表所示。
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A.前 5 min 的平均反应速率为v(SO2) = 0.08 mol/(L·min)
B.保持温度不变,向平衡后的容器中再充入 0.2 mol SO2(g)和 0.2 mol SO3(g)时, v正 > v逆
C.保持其他条件不变,若起始时向容器中充入 2 mol SO3(g),达到平衡状态时吸收 78.4 kJ的热量
D.相同条件下,起始时向容器中充入 1.5 mol SO3(g),达到平衡状态时 SO3 的转化率为 40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其原子序数依次增大,且质子数均小于18。A元素原子的最外层只有1个电子,该元素阳离子与N3-核外电子排布相同;B元素原子核外各轨道上均无成单电子;C元素原子的价电子排布为ns2np2;D-的核外电子构型与Ar相同。
(1)写出A、C、D的元素符号:A________,C________,D________。
(2)写出B元素电子的电子排布式________;D元素电子的电子排布图______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技进步和人类环保意识的增强,如何利用CO2已经成为世界各国特别关注的问题。
已知:CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
(1)降低温度,该反应速率会_______________(填“增大”或“减小”);一定压强下,由最稳定单质生1 mol化合物的焓变为该物质的摩尔生成焓。已知CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。则上述重整反应的ΔH=____________kJ/mol。
(2)T1℃时,在两个相同刚性密闭容器中充入CH4和CO2分压均为20 kPa,加入催化剂Ni/α-Al2O3并分别在T1℃和T2℃进行反应,测得CH4转化率随时间变化如图Ⅰ所示。
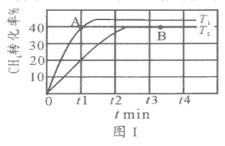
①A点处v正_______B点处(填“<”、“>”或“=”)
②研究表明CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A点处v生成(CO)=__________mol·g-1·s-1。
(3)上述反应达到平衡后,若改变某一条件,下列变化能说明平衡一定正向移动的是________________(填代号)。
A.正反应速率增大 B.生成物的百分含量增大 C.平衡常数K增大
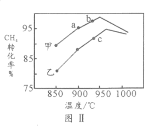
(4)其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图Ⅱ,C点___________________(填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____________;CH4的转化率b点高于a点的可能原因是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH== - Q1 ;
2H2(g)+O2(g) →2H2O(g) ΔH== - Q2;
H2O(g) →H2O(l) ΔH== - Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为
A.4Q1+0.5Q2B.4Q1+Q2+10Q3C.4Q1+2Q2D.4Q1+0.5Q2+9Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在工农业生产中应用广泛。
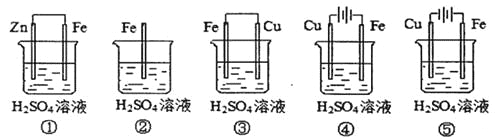
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为_______。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是____________(用序号填写)。
(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)![]() H=-1118 kJ·mol-1
H=-1118 kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s)![]() H=-1675.7 kJ·mol-1
H=-1675.7 kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为______________。
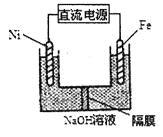
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式______。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是______________。
(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是____________。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为____。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]=______。
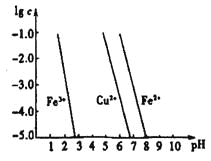
已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度![]() 10-5mol·L-1时,可认为沉淀完全)。
10-5mol·L-1时,可认为沉淀完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车内燃机燃烧时,在高温引发氮气和氧气反应会产生 NOx 气体,NOx 的消除是科研人员研究的重要课题。
(1)通过资料查得 N2(g)+O2(g)2NO(g)△H反应温度不平衡常数的关系如下表:
反应温度/℃ | 1538 | 2404 |
平衡常数 |
|
|
则△H___________________0(填“<”“>”戒“=”)
(2)在 800℃时,测得 2NO(g)+O2(g) 2NO2(g)的反应速率不反应物浓度的关系如下表所示
初始浓度/ | 初始速率/ | |
C0(NO) | C0(O2) | |
0.01 | 0.01 |
|
0.01 | 0.02 |
|
0.03 | 0.02 |
|
已知反应速率公式为 V 正=K 正×c m(NO)cn(O2),则 m=___________________, K 正=___________________L2mol-2s-1
(3)在某温度下(恒温),向体积可变的容器中充人 NO2 气体,发生反应 2NO2(g) N2O4(g),气体分压随时间的变化关系如图
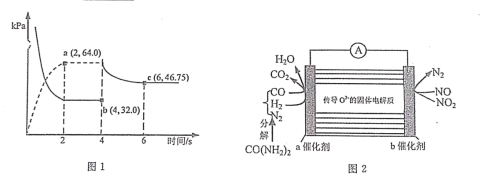
①该反应的压力平衡常数 KP=___________________。
②4s 时压缩活塞(活塞质量忽略不计)使容器体积变为原体积的 1/2,6s 时重新达到平衡,则P(N2O4)=___________________kPa。
(4)某学习小组利用图 2 装置探究向汽车尾气中喷入尿素溶液处理氮的氧化物。则该装置工作时,NO2 在 b 电极上的电极反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中互为同分异构体的有____,互为同素异形体的 有________,互为同位素的有________,是同一种物质的有________(填序号)。
(1)液氯 (2)氯气(3)白磷(4)红磷 (5)35Cl (6)37Cl
(7)![]() (8)
(8)![]() (9)CH2=CH-CH3 (10)
(9)CH2=CH-CH3 (10)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向质量为6.5g的Al和Fe的混合物中加入一定量稀HNO3恰使混合物完全溶解,放出NO(标准状况)2.24L,所得溶液中再滴加KSCN溶液,无红色出现。若用相同质量的上述混合物与足量的稀硫酸充分反应,所得到的气体在标准状况下的体积为( )
A.15.12LB.10.08LC.2.24LD.3.36L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com