
| A. | “梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的相同 | |
| B. | 制作烟花的过程中常加入金属发光剂和发色剂使烟花放出五彩缤纷的颜色 | |
| C. | 草莓棚中使用的“吊袋式二氧化碳气肥”的主要成分可以是碳酸钙 | |
| D. | 芒硝晶体(Na2SO4•10H2O)白天在阳光下曝晒后失水、溶解吸热,晚上重新结晶放热,实现了太阳能转化为化学能继而转化为热能 |
分析 A.柳絮的主要成分和棉花的相同,都是纤维素;
B.许多金属元素发生焰色反应会出现不同的色彩;
C.碳酸钙需要在高温下煅烧分解得到二氧化碳;
D.Na2SO4•10H2O白天在阳光下曝晒后失水能量转换形式为太阳能和化学能的转化.
解答 解:A.梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的相同,都是纤维素,故A正确;
B.金属元素发生焰色反应会出现不同的色彩,烟花放出五彩缤纷的颜色和元素的焰色反应、烟花中的加入金属发光剂和发色剂有关系,故B正确;
C.碳酸钙需要在高温下煅烧分解得到二氧化碳,草莓棚中不能使用碳酸钙来产生二氧化碳,故C错误;
D.Na2SO4•10H2O失水和结晶属于化学变化,能量转换形式为化学能和热能的转化,白天在阳光下曝晒后失水,转换形式为太阳能和化学能的转化,故D正确;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 第IIA族元素的金属性比第IIIA族元素的强 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | O2-、F-、Na+、Mg2+半径逐渐减小 | |
| D. | 16O与18O得电子能力前者强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
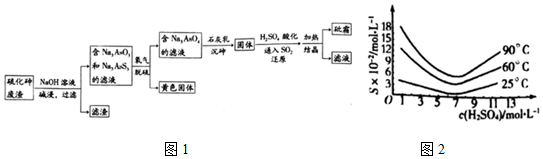
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烹鱼时加入少量的料酒和食醋可减少腥味,增加香味 | |
| B. | 少数商贩在蔬菜表面洒福尔马林,用于食品保鲜 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 某新型航天服材料主要成分是碳化硅陶瓷和碳纤维复合而成,是一种新型复合材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的△H=+91kJ•mol-1 | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 反应物的总能量大于生成物的总能量 | |
| D. | 如果该反应生成液态CH3OH,则△H增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com