
| A. | 酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后,不需要干燥 | |
| B. | 在量取液体后,量筒中残留的液体要用蒸馏水洗涤并转入相应容器 | |
| C. | 在测量或监测温度时,温度计水银球不能碰到容器内璧或底部 | |
| D. | 分液漏斗使用前需要检漏,确认不漏水后方可使用 |
分析 A.锥形瓶用蒸馏水洗涤后,不需要干燥,对实验无影响;
B.量筒中残留的液体不需要用蒸馏水洗涤;
C.温度计水银球不能碰到容器内璧或底部,否则温度不准确;
D.分液漏斗使用前需要检漏,若漏水不能使用.
解答 解:A.锥形瓶用蒸馏水洗涤后,不需要干燥,对实验无影响,不改变酸、碱的物质的量,故A正确;
B.量筒中残留的液体不需要用蒸馏水洗涤,若洗涤并转入相应容器,量取的液体偏多,故B错误;
C.在测量或监测温度时,温度计水银球不能碰到容器内璧或底部,否则温度不准确,故C正确;
D.分液漏斗使用前需要检漏,若漏水不能使用,确认不漏水后方可使用,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的结构及使用、实验基本操作和实验技能为解答本题关键,侧重分析与实验能力的考查,注意常见仪器的使用方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:NO3-、SO42-、Fe2+、Na+ | |
| B. | 强碱性溶液中:NH4+、NO3-、Ba2+、K+ | |
| C. | 澄清透明的溶液中:MnO4-、Al3+、SO42-、K+ | |
| D. | 含大量Fe3+的溶液中:Mg2+、Na+、Cl-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
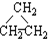
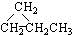
| A. | ⑤和⑥ | B. | ①和③ | C. | ①和④ | D. | ①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应生成了1.12L(标准状况)H2 | |
| B. | 向反应后的溶液中加入足量小苏打,最终有白色沉淀生成 | |
| C. | 在反应后的溶液中一定能大量共存的粒子有:K+、Mg2+、I-、NO3- | |
| D. | 向反应后的溶液中加入足量稀硫酸,最终有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3n+2}{2}$ | B. | $\frac{3n-2}{2}$ | C. | $\frac{2n-2}{3}$ | D. | n+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、I-、NO3- | ||
| C. | Fe2+、Cu2+、AlO2-、ClO- | D. | Na+、Ca2+、Cl-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com