
| 物质 温度 | KMnO4 | CH3COOK | K2SO4 | KCl |
| 20℃ | 6.34 | 217 | 11.1 | 34.2 |
| 90℃ | 45.2 | 398 | 22.9 | 53.9 |
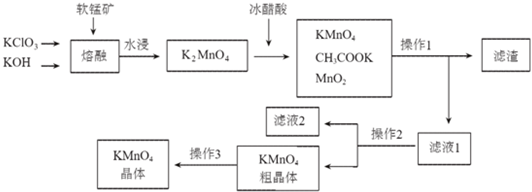
分析 软锰矿中的二氧化锰和加入氯酸钾和氢氧化钾熔融发生氧化还原反应生成锰酸钾、氯化钾和水,锰酸钾中加入冰醋酸自身发生氧化还原反应生成二氧化锰、高锰酸钾和醋酸钾,操作Ⅰ是溶解过滤得到滤渣为二氧化锰,操作Ⅱ是滤液2通过加热浓缩、降温结晶、过滤洗涤得到高锰酸钾粗晶体,所含杂质主要为KCl、CH3COOK等,通过重结晶的方法提纯高锰酸钾晶体,
(1)软锰矿中的二氧化锰和加入氯酸钾和氢氧化钾熔融发生氧化还原反应生成锰酸钾、氯化钾和水,结合原子守恒和电子守恒配平书写化学方程式;
(2)K2MnO4溶液中加入冰醋酸发生反应是自身氧化还原反应生成高锰酸钾和二氧化锰,结合电子守恒、电荷守恒和原子守恒书写离子方程式;
(3)操作2是滤液2通过加热浓缩、降温结晶、过滤洗涤得到高锰酸钾粗晶体;
(4)参加反应过程最后又生成的物质可以循环使用;
(5)高锰酸钾粗晶体,所含杂质主要为KCl、CH3COOK等,若用硫酸代替图中的冰醋酸,生成的硫酸钾溶解度小易在晶体中含有更多杂质;
解答 解:软锰矿中的二氧化锰和加入氯酸钾和氢氧化钾熔融发生氧化还原反应生成锰酸钾、氯化钾和水,锰酸钾中加入冰醋酸自身发生氧化还原反应生成二氧化锰、高锰酸钾和醋酸钾,操作Ⅰ是溶解过滤得到滤渣为二氧化锰,操作Ⅱ是滤液2通过加热浓缩、降温结晶、过滤洗涤得到高锰酸钾粗晶体,所含杂质主要为KCl、CH3COOK等,通过重结晶的方法提纯高锰酸钾晶体,
(1)软锰矿中的二氧化锰和加入氯酸钾和氢氧化钾熔融发生氧化还原反应生成锰酸钾、氯化钾和水,结合原子守恒和电子守恒配平书写化学方程式,锰元素化合价+4价变化为+6价电子转移2e-,氯酸钾中氯元素+5价变化为-1价,电子转移6e-,电子转移总数6e-,则反应的化学方程式为:3MnO2+KClO3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O,
故答案为:3MnO2+KClO3+6KOH$\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;
(2)K2MnO4溶液中加入冰醋酸发生反应是自身氧化还原反应生成高锰酸钾和二氧化锰,结合电子守恒、电荷守恒和原子守恒书写离子方程式,锰元素+6价变化为+7价和+4价,电子转移总数2e-,配平得到离子方程式为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-,
故答案为:3MnO42-+4CH3COOH=2MnO4-+MnO2↓+2H2O+4CH3COO-;
(3)操作Ⅱ是溶液中得到溶质固体,依据表中溶解度分析可知,溶解度随温度变化较大,可以用冷却热饱和溶液的方法得到,操作2为滤液2通过蒸发浓缩、冷却结晶、过滤洗涤得到高锰酸钾粗晶体,
故答案为:蒸发浓缩、冷却结晶、过滤;
(4)参加反应过程最后又生成的物质可以循环使用,上述分析可知二氧化锰参与反应又生成可以循环使用,
故答案为:MnO2;
(5)高锰酸钾粗晶体,所含杂质主要为KCl、CH3COOK等,若用硫酸代替图中的冰醋酸,生成的硫酸钾溶解度小易在晶体中含有更多杂质,硫酸酸性太强,导致MnO4-将Cl-氧化,产生有毒的Cl2,KMnO4损失且纯度降低,
故答案为:KCl,CH3COOK,反应生成K2SO4,而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低或硫酸酸性太强,导致MnO4-将Cl-氧化,产生有毒的Cl2,KMnO4损失且纯度降低;
点评 本题考查了物质提纯和分离的生产过程分析,主要是氧化还原反应产物的理解应用,注意化学方程式、离子方程式书写,转化关系中的实验操作和分离方法是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 测定时可用氯水代替过氧化氢氧化甲醛 | |
| B. | 足量H2O2氧化1molHCHO时放出的热量-定是①的2倍 | |
| C. | 上述方法测定甲醛含量时,如果H2O2过量,会导致甲醛含量的测定结果偏高 | |
| D. | H2O2氧化甲醛(反应①)和氧化甲酸的原理相同,氧化等量甲醛和甲酸时转移电子的数目也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4•5H2O | B. | FeSO4•7H2O | C. | KAl(SO4)2•12H2O | D. | Fe2(SO4)3•9H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
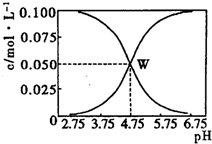 25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述不正确的是( )| A. | 由题给图示可求出25℃时醋酸的电离平衡常数Ka=10-4.75 | |
| B. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1 | |
| D. | 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH))+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2被还原 | B. | CO是氧化剂 | C. | CO发生还原反应 | D. | NO2失去电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油里 | |
| B. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| C. | 为防止氧化,FeSO4溶液存放在加有少量铜粉的试剂瓶中 | |
| D. | 硝酸应装在棕色瓶中密封避光保存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com