
| A. | 同周期X、Y、Z元素的最高价含氧酸的酸性:HXO4>H2YO4>H3ZO4,则气态氢化物还原性HX<H2Y<ZH3 | |
| B. | 元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式就是RH4 | |
| C. | 金属与非金属元素分界线附近的元素是过渡元素 | |
| D. | 物质的量相同的Na+、O2-、NH3三种微粒,一定含有相同的质子 |
分析 A.同一周期元素,元素的非金属性越强,其最高价氧化物的水化物酸性越强(O、F元素除外),其气态氢化物的还原性越弱;
B.元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式不一定是RH4;
C.过渡元素包含副族与Ⅷ族元素;
D.分子、原子、阴阳离子中质子数=各元素原子质子数之和.
解答 解:A.同一周期元素,元素的非金属性越强,其最高价氧化物的水化物酸性越强(O、F元素除外),其气态氢化物的还原性越弱,所以同周期X、Y、Z元素的最高价含氧酸的酸性:HXO4>H2YO4>H3ZO4,非金属性X>Y>Z,则气态氢化物还原性HX<H2Y<ZH3,故A正确;
B.元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式不一定是RH4,如果R是S元素,则其氢化物是H2S,故B错误;
C.过渡元素包含副族与Ⅷ族元素,金属和非金属元素分界线处的元素为主族元素,故C错误;
D.分子、原子、阴阳离子中质子数=各元素原子质子数之和,物质的量相同的Na+、O2-、NH3三种微粒,其质子数之比为11:8:10,故D错误;
故选A.
点评 本题考查元素周期表和元素周期律,为高频考点,涉及非金属性强弱判断、元素周期表结构、质子数的计算,把握非金属性强弱判断方法、质子数的计算方法是解本题关键,易错选项是B,注意选项中的酸并不是该元素的最高价含氧酸.


科目:高中化学 来源: 题型:解答题
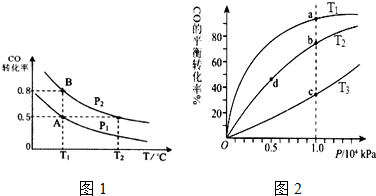
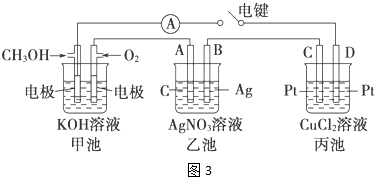
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
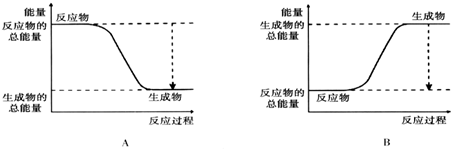
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
| 化学键 | 填“吸收”或“放出”能量 | 能量变化(kJ) | |
| 拆开化学键 | 2molH2中的化学键 | ①吸收热量 | ④1368 |
| 1molO2中的化学键 | |||
| 形成化学键 | 4molH-O键 | ②放出热量 | ⑤1852 |
| 总能量变化 | ③放出热量 | ⑥484 | |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
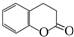 )常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品,鉴别二氢香豆素和它的一种同分异构体(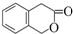 )需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.
)需要用到的试剂有:NaOH溶液、稀硫酸和氯化铁溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA | |
| B. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| C. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| D. | 常温下,4gCH4含有NA 个C-H共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | A-A | B=B | A-B |
| 键能kJ/mol | 236 | 406 | 163 |
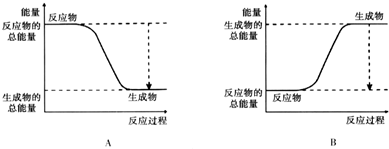
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
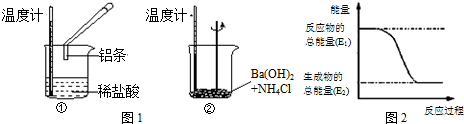
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
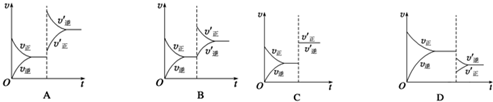
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com