
| A. | 稀硝酸 | B. | 浓硝酸 | C. | 浓硫酸 | D. | 浓盐酸 |
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
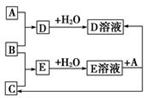 已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.
已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
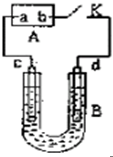 如图,A为直流电源,B为电解槽,c、d为石墨电极,B中存放有100mL NaCl和CuCl2的混合溶液,其中Cu2+的物质的量浓度为0.1mol/L,闭合K,d极收集到标准状况下448mL的一种气体甲,该气体能使湿润的碘化钾淀粉试纸变蓝.气体体积均在标准状况下测定,假设溶液的体积变化忽略不计,不考虑电解产生的气体溶解和吸收.请回答下列问题.
如图,A为直流电源,B为电解槽,c、d为石墨电极,B中存放有100mL NaCl和CuCl2的混合溶液,其中Cu2+的物质的量浓度为0.1mol/L,闭合K,d极收集到标准状况下448mL的一种气体甲,该气体能使湿润的碘化钾淀粉试纸变蓝.气体体积均在标准状况下测定,假设溶液的体积变化忽略不计,不考虑电解产生的气体溶解和吸收.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- | |
| B. | 向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ | |
| C. | 向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ | |
| D. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色,说明原溶液中不含K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 使酚酞呈红色的溶液:K+、Na+、NO3-、Cl- | |
| C. | 由水电离出的c(H+)=1×10-10mol•L-1的溶液:Mg2+、NH4+、SO42-、HCO3- | |
| D. | 0.1mol•L-1FeCl3溶液:Fe2+、SO42-、NH4+、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠用于潜艇供氧 | B. | 氧化铁用做红色颜料 | ||
| C. | 在海轮的外壳上焊接铜板防腐 | D. | 铝制槽车可用来储运浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com