
|
燃料电池 (如CO、CH4、CH3OH等与O2组成),用惰性电极插入KOH溶液中,在两极分别通入CH3OH和O2,有关此电池判断正确的是 | |
| [ ] | |
A. |
正极反应: 2CH3OH+2H2O--12e- |
B. |
放电一段时间后,溶液的 pH值升高 |
C. |
该电池在工作时,每消耗 32 g CH3OH,外电路中通过6 mol e- |
D. |
放电一段时间,阳离子向负极移动,阴离子向正极移动 |
科目:高中化学 来源: 题型:阅读理解
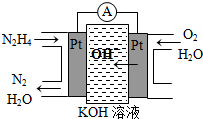 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
| 2 |
| 3 |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
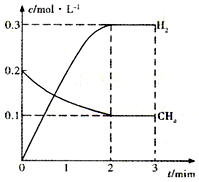 工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.
工业上利用天然气(主要成分是CH4)与H2O进行高温重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚等多种有机物.已知CH4、H2和CO的燃烧热(△H)分别为-890.3kJ?mol-1、-285.8kJ?mol-1和-283.0kJ?mol-1;18.0g水蒸气液化时的能量变化为44.0kJ.| t/min | n(CH4)/mol | n(H2O)/mol | n(CO)/mol | n(H2)/mol |
| 4 | 0.18 | 0.38 | 0.22 | 0.66 |
| n(CH4) |
| n(H2O) |
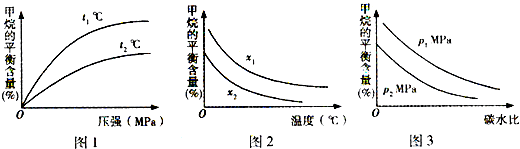
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?上饶一模)能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.
(2012?上饶一模)能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.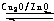 CH3OH(g).甲醇的物质的量与反应温度的关系如图所示:
CH3OH(g).甲醇的物质的量与反应温度的关系如图所示: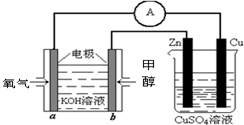
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省扬州市高三下学期5月考前适应性考试化学试卷(解析版) 题型:填空题
以甲醇为替代燃料是解决我国石油资源短缺的重要措施。
(1)CO、CO2可用于甲醇的合成,其相关反应的热化学方程式如下:
CO(g)+2H2(g)=CH3OH(g) △H=" -102.5" kJ·mol-1
CO(g)+H2O(g) = CO2(g)+H2(g) △H ="-42.9" kJ·mol-1
则反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H = kJ·mol-1
反应CO(g)+H2O(g) = CO2(g)+H2(g)的平衡常数K的表达式为 。
(2)用CO2合成甲醇时可选用亚铬酸锌(ZnCr2O4)或CuCl为催化剂。
①工业制备亚铬酸锌是用CO还原ZnCrO4·H2O,同时生成ZnO。该反应的化学方程式是 。以亚铬酸锌为催化剂时,工业上的适宜温度是:350℃~420℃,可能的原因是 。
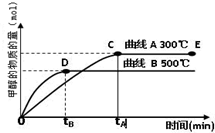
② CuCl是不溶于水的白色固体,制备时向CuCl2溶液中加入过量铜粉,发生反应CuCl2+Cu=2CuC1。在实验过程中应先加入浓盐酸,发生反应CuCl + HCl H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7。
H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7。
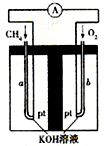
(3)直接甲醇燃料电池结构如图所示,则负极反应是 。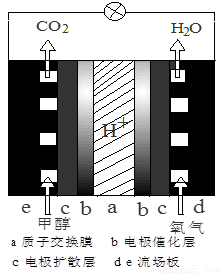
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com