
分析 (1)根据m(溶质)=m(溶液)×ω(溶质)计算出溶液中CuCl2的质量,再计算出CuCl2的物质的量;
(2)根据c=$\frac{n}{V}$计算出氯化铜溶液的浓度.
解答 解:(1)0.270kg质量分数为10%的CuCl2溶液中m(CuCl2)=270g×10%=27g,所以n(CuCl2)=$\frac{27g}{135g/mol}$=0.2mol,
答:CuCl2的物质的量0.2mol;
(2)所得溶液的浓度为:c(CuCl2)=$\frac{0.2mol}{0.2L}$=1mol/L,
答:溶液中CuCl2的物质的量浓度为1mol/L.
点评 本题考查了物质的量浓度的计算,题目等浓度,明确物质的量与摩尔质量、物质的量浓度之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1-丁烯和2-甲基-1-丁烯 | B. | 己烷和环己烷 | ||
| C. | 尿素CO(NH2)2和氰酸铵 (NH4CNO) | D. | 乙苯和丙苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
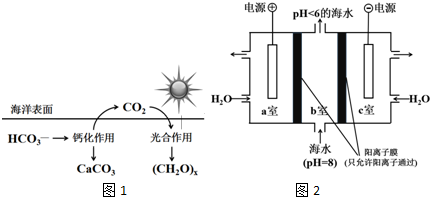
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与Cu反应生成CuO,S与Cu反应生成CuS | |
| B. | CaC2能水解:CaC2+2H2O=Ca(OH)2+C2H2↑,则Al4C3也能水解:Al4C3+12H2O═4Al(OH)3+3CH4↑ | |
| C. | 根据化合价Fe3O4可表示为FeO•Fe2O3,则Pb3O4也表示为PbO•Pb2O3 | |
| D. | SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液不产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
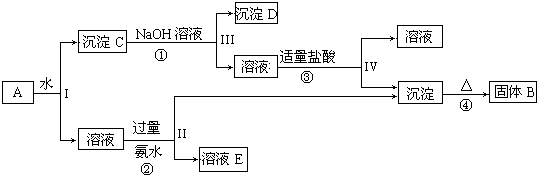
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA | |
| B. | 100ml 1mol/L的FeCl3溶液中Fe3+数目为0.1NA | |
| C. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com