
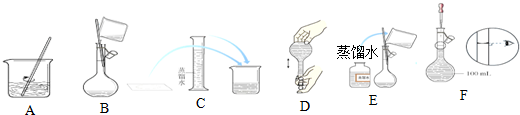
分析 (1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(2)①依据用浓溶液配制稀溶液的操作步骤选择合适的仪器;
②分析操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析;
③依据定容的正确操作解答;
(3)依据用pH测量的溶液pH值的正确操作解答,使用pH试纸不能润湿,否则相当于将溶液稀释.
解答 解:(1)配制一定物质的量浓度溶液的操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以正确的顺序为:C A B E F G;
故答案为:C A B E F G;
(2)①用浓溶液配制稀溶液的操作步骤,计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,用到的仪器:量筒、胶头滴管、玻璃棒、100mL容量瓶、胶头滴管;所以还缺少的仪器:10 mL量筒(或量筒) 100 mL容量瓶;
故答案为:10 mL量筒;100 mL容量瓶;
②a.设需要浓硫酸体积为V,则依据溶液稀释规律,V×18mol/L=100mL×0.5mol•L-1,解得V=2.8mL,
准确量取2.7mL浓硫酸,则量取的硫酸的物质的量偏小,溶液浓度偏低,故选;
b.待溶解后立即转移到100mL容量瓶中,冷却后溶液体积偏小,溶液浓度偏高,故不选;
C.用少量的稀硫酸将容量瓶洗涤2~3次,导致溶质的物质的量偏大,溶液浓度偏高,故不选;
d.向容量瓶中加水至超过刻度线,用胶头滴管吸出后再定容至100mL,导致溶质的物质的量偏小,溶液浓度偏低,故选;
故选:ad;
③定容的正确操作:加水接近刻度线1 cm~2 cm处,改用胶头滴管小心地加水,使溶液的凹液面与刻度线相切;
故答案为:加水接近刻度线1 cm~2 cm处,改用胶头滴管小心地加水,使溶液的凹液面与刻度线相切;
(3)10mL,0.5mol•L-1稀硫酸,向其中加水至100mL,稀释后溶液浓度为0.5mol/L×$\frac{10}{100}$=0.05mol/L;
则氢离子浓度为0.1mol/L,溶液pH为1;
用PH试纸测其PH的正确操作是:取一片PH试纸放在玻璃片上,用玻璃棒蘸取稀硫酸点在PH试纸中央,然后再与标准比色卡对照读数;
若他测得PH为2,可能是因为pH试纸预先湿润了;
故答案为:取一片PH试纸放在玻璃片上,用玻璃棒蘸取稀硫酸点在PH试纸中央,然后再与标准比色卡对照读数; 可能先把PH试纸湿润了.
点评 本题考查了一定物质的量浓度溶液的配制,熟悉配制原理、过程是解题关键,注意pH使用方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入NaOH溶液,生成蓝色沉淀,说明原溶液中含有Cu2+ | |
| B. | 某溶液中加入BaCl2溶液,生成白色沉淀,说明原溶液中含有SO42- | |
| C. | 某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中含有Cl- | |
| D. | 某溶液中加入稀硫酸,产生无色气体,将气体通入澄清石灰水中生成白色沉淀,说明原溶液中含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某反应由两步反应A═B═C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能).下列有关叙述正确的是( )
某反应由两步反应A═B═C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能).下列有关叙述正确的是( )| A. | 两步反应均为放热反应 | |
| B. | 三种化合物的稳定性顺序:B<A<C | |
| C. | 整个反应的△H=E1-E2 | |
| D. | 加入催化剂不改变反应的焓变,但能提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盛有10mL水的量筒中倒入浓硫酸即得稀硫酸 | |
| B. | 向试管中滴加试剂时,将滴管下端紧靠试管内壁 | |
| C. | 使用试纸检验溶液的性质时,将试纸浸入溶液中 | |
| D. | 用托盘天平称量药品时,左盘放药品,右盘放砝码 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com