
在2A + B=3C + 4D的反应中,下列表示该反应的化学反应速度最快的是
A.v (A)=0.5 mol/(L·s) B.v (B)= 0.3 mol/(L·s)
C.v (C)=0.8 mol/(L·s) D.v (D)=1.0 mol/(L·s)
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行l0 min,溶液的pH由7变为l 2。
①N2的结构式为
②上述反应的离子方程式为 ,其平均反应速率v(NO3-)为 mol·L-1·min-1。
③还原过程中可生成中间产物NO2-,写出2种促进NO2-水解的方法
.
(2)电化学降解NO3-的原理如下图所示。

①电源正极为 (填“A”或“B”),阴极反应式为:
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气。
进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):
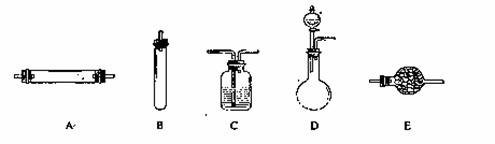
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用_____________________(选填装置编号)。请写出生石灰在此反应中的两个作用:__________________________________,___________________________________________.
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置_________________
(选填装置编号)中加入_________________________以除去其它杂质气体。
(3)方法三:制氮气的化学方程式为:_____________________________________________。
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂。在制取氮气的3种方法中,联合使用方法—和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:_____________
______________________________________________________________________________.
(5) 1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右。若上述实验设计与操作均无错误,且氮气已完全干燥,
请解释产生这一现象的原因:_______________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下的反应N2(g)+ 3 H2(g) 2NH3(g) △H<0达到平衡,下列变化既能加快反应速率又能使平衡向正反应方向移动的是
2NH3(g) △H<0达到平衡,下列变化既能加快反应速率又能使平衡向正反应方向移动的是
A.升温 B.加压 C.减压 D.加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI>AgBr B.AgCl>AgBr>AgI
C.AgBr>AgCl>AgI D.AgBr>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,水的电离达到平衡:H2O 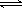 H+ + OH- ,下列叙述正确的是
H+ + OH- ,下列叙述正确的是
A.向水中加入氨水,平衡逆向移动,c(OH-)降低
B.向水中加入盐酸,平衡逆向移动,c(H+)增大
C.向水中加入少量固体氢氧化钠,c(H+)减小KW不变
D.将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化钙(CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,图1是模拟制取装置:
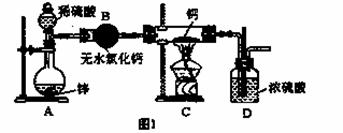
(1)装置B的作用是 ;装置D的作用是 ;
(2)利用图1实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞, (请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是: 。
(4)甲同学设计一个实验,测定上述实验中得到的氢化钙的纯度(杂质中不含钙元素。请完善下列实验步骤:
①样品称量;②加入________溶液(填化学式),搅拌、过滤;③________(填操作名称);④_______ (填操作名称); ⑤称量碳酸钙。
(5)乙同学利用注射器测量氢化钙和水反应氢气体积的方法,测定上述实验中得到的氢化钙的纯度。他称取46 mg 所制得的氢化钙样品,记录开始时注射器活栓停留在10.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处(上述气体体积均在标准状况下测定)。试通过计算求样品中氢化钙的纯度: 。
(6)请你再设计一种氢化钙纯度的测定方法:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com