
 (1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:
(1)已知:在常温下,浓度均为0.1mol•L-1的下列六种溶液的pH:| 溶质 | CH3CO ONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
分析 (1)强碱弱酸盐水解显示碱性,溶液的pH越大,水解程度越大,对应的酸的酸性越弱,复分解反应中,碱性强的物质置换碱性弱的物质,酸性强的物质置换酸性弱的物质.根据以上知识对各选项进行判断即可;
(2)浓度均为0.05mol/L的六种物质的溶液,氢离子浓度越大pH越小,反之越大,强酸的电离程度大于弱酸的电离程度;酸性越弱,稀释相同倍数变化越小;
(3)少量氯气通入碳酸钠溶液中,二者反应生成碳酸氢钠、氯化钠和次氯酸钠;
(4)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中不断通入CO2至过量,反应过程是二氧化碳和氢氧根离子反应生成碳酸根离子,碳酸根离子和钙离子反应生成碳酸钙沉淀,钙离子沉淀完,二氧化碳继续和氢氧根离子反应生成碳酸根离子,氢氧根离子全部反应后,二氧化碳和碳酸根离子反应生成碳酸氢根离子,继续通入二氧化碳和碳酸钙沉淀反应生成碳酸氢钙,沉淀溶解,依据反应的定量关系画出图象.
解答 解:(1)A.C6H5ONa溶液的pH=11.3<Na2CO3溶液的pH=11.6,所以CH3COOH+Na2CO3═NaHCO3+CH3COONa能成立,故A不选;
B.NaCN溶液的pH=11.1>CH3COONa溶液的pH=8.8,所以CH3COOH+NaCN=CH3COONa+HCN能成立,故B不选;
C.由表可知NaClO溶液的pH=10.3<Na2CO3溶液的pH=11.6,所以CO2+H2O+2NaClO=Na2CO3+2HClO不能成立,由表可知NaClO溶液的pH=10.3>NaHCO3溶液的pH=9.7,所以CO2+H2O+NaClO=NaHCO3+HClO能成立,故C选;
D.C6H5ONa溶液的pH=11.3>NaHCO3溶液的pH=9.7,所以CO2+H2O+C6H5ONa→NaHCO3+C6H5OH能成立,由表可知、C6H5ONa溶液的pH=11.3<Na2CO3溶液的pH=11.6,所以CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH不能成立,故D选;
故答案为:CD;
(2)均为0.05mol•L-1的下列六种物质的溶液,只有硫酸是二元强酸,电离出的氢离子浓度最大,所以酸性最强,pH最小,根据表中pH数据,可知几种物质苯酚的酸性最弱,电离程度最小,所以氢离子浓最小,pH最大,苯酚酸性最弱,则苯酚稀释时pH变化最小,故答案为:⑤;①;
(3)少量氯气通入碳酸钠溶液中,二者反应生成碳酸氢钠、氯化钠和次氯酸钠,离子方程式为:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-,故答案为:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-;
(4)标准状况下,向1L含NaOH、Ca(OH)2各0.1mol的溶液中含氢氧根离子为0.3mol,不断通入CO2至过量,CO2+2OH-═CO32-+H2O,Ca2++CO32-═CaCO3↓,CO2+2OH-═CO32-+H2O,CO32-+CO2+H2O═2HCO3-,CaCO3+CO2+H2O═Ca(HCO3)2,生成碳酸钙最大量为0.1mol,消耗氢氧根离子0.2mol,消耗二氧化碳气体0.1mol,标准状况体积为2.24L,剩余氢氧根离子为0.1mol,生成碳酸根离子物质的量为0.05mol,消耗二氧化碳0.05mol,继续通入二氧化碳和碳酸根离子反应生成碳酸氢根离子,消耗二氧化碳0.05mol,沉淀不变消耗二氧化碳0.1mol,标准状况体积为2.24L,再继续通入二氧化碳溶解碳酸钙沉淀需要二氧化碳0.1mol,标准状况体积为2.24L,由数据绘制图形得到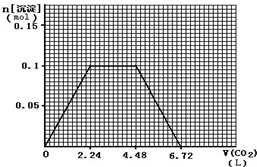 ,
,
故答案为: .
.
点评 本题考查较综合,涉及盐类水解的应用、溶液酸碱性及化学方程式的书写等,把握反应原理为解答的关键,注重高频考点的考查,注意利用计算判断反应过程中物质的量的变化来绘制图象,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
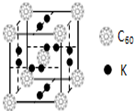 C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮.继C60后,科学家又合成了Si60、N60等球形分子.
C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮.继C60后,科学家又合成了Si60、N60等球形分子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
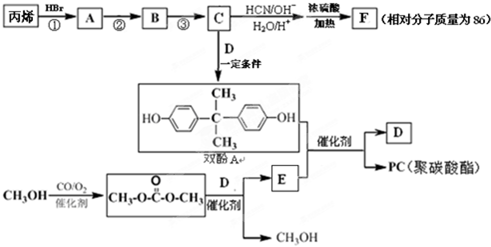

 .
.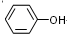 .
. .
.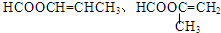 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
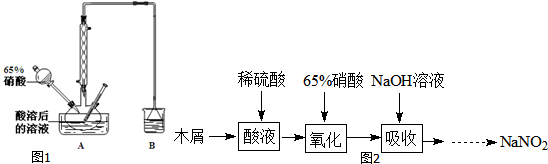
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com