
【题目】常温下,向20 mL 0.1 mol/L的K2CO3溶液中逐滴加入0.1 mol/L的稀盐酸40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。下列说法正确的是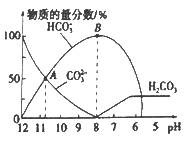
A.随着稀盐酸的加入,溶液中 ![]() 保持不变
保持不变
B.根据A点计算,Ka2 (H2CO3)的数量级为10-3
C.B 点所处的溶液中:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D.当pH约为8时,溶液中开始放出CO2气体
【答案】A
【解析】A. 在碳酸钾的溶液中存在碳酸根的水解平衡,CO32-+H2OHCO3-+OH-,其平衡常数为Kh= ![]() ,所以随着稀盐酸的加入,只要温度不变,溶液中
,所以随着稀盐酸的加入,只要温度不变,溶液中 ![]() 保持不变,A符合题意;
保持不变,A符合题意;
B.A点pH大于10而小于11,所以c(H+)大于10-11而小于10-10,又因为此时c(CO32-)=c(HCO3-),所以Ka2 (H2CO3)= ![]() = c(H+),其数量级为10-11~10-10,A不符合题意;
= c(H+),其数量级为10-11~10-10,A不符合题意;
C. B点所处的溶液中存在电荷守恒c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),所以C不符合题意;
D. 由图像可知,当pH约为8时,溶液为碳酸氢钾溶液,pH小于8以后才开始放出CO2气体,D不符合题意。
所以答案是:A
【考点精析】本题主要考查了离子积常数的相关知识点,需要掌握水的离子积Kw=c(H+)·c(OH–)=10–14(25℃)①Kw只与温度有关,温度升高,Kw增大;如:100℃ Kw=10–12②Kw适用于纯水或稀酸、稀碱、稀盐水溶液中才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③
B.①③④
C.②③
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)将4molN2和6molO2混合,所得气体在标准状况下的密度是_______g/L。
(2)有Na2SO4和Fe2(SO4)3的混合溶液中,已知其中c(Fe3+)=0.4mol/L,c(SO42-)=0.7mol/L,则此溶液中c(Na+)=_______mol/L。
(3)某普通酒精中乙醇的含量为97%,密度为0.90g/cm3,将乙醇看作溶剂,水看作溶质,该普通酒精中水的物质的量浓度是________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现需配制物质的量浓度为1mol/L的NaOH溶液480mL。
(1)配制该溶液的实验步骤包括:
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入容量瓶中,洗涤烧杯和玻璃棒,将洗涤液全部转移入容量瓶中;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用__滴加蒸馏水至凹液面与刻度线相切。
上述步骤的正确操作顺序是____________________。
(2)使用__mL的容量瓶配制此溶液,需要称量NaOH固体的质量为__g。
(3)下列操作会使所配制溶液浓度偏大的有________。
A.容量瓶中原有少量蒸馏水
B.转移溶液时,没有洗涤玻璃棒和溶解用的烧杯
C.定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线
D.定容时,俯视观察液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C和Si元素在化学中占有极其重要的地位:
(1)写出Si的基态原子核外电子排布式 . 从电负性角度分析,C,Si和O元素的非金属活泼性由强至弱的顺序为 .
(2)CO2分子的空间构型为 , 中心原子的杂化方式为 , 和CO2 互为等电子体的氧化物是 .
(3)C,Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键.
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为 , 在SiC中,每个C原子周围最近的C原子数目为 , 若晶胞的边长为a pm,则金刚砂的密度为 . 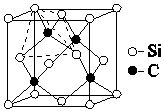
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol·L-1Ba(OH)2溶液300mL,反应后溶液中SO42﹣的物质的量浓度为( )
A. 0.4mol·L-1 B. 0.3mol·L-1 C. 0.2mol·L-1 D. 0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取5.48gNa2CO3和NaHCO3的混合物溶于水配成200mL溶液,将溶液分成两等份。
(1)往其中一份溶液中加入300mLBa(OH)2溶液时,恰好使生成白色沉淀的量最多,测得反应后溶液的c(OH-)=0.100mol·L-1 (混合溶液体积改变忽略不计),则原混合物中n(Na2CO3) : n(NaHCO3)=。
(2)往另一份溶液中缓慢滴加0.l00mol·L-1盐酸,当加入的盐酸体积为300mL时,则收集到的CO2气体在标准状况下的体积为L(不考虑CO2在水中的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1) 仪器a的名称为________;仪器b中可选择的试剂为________;
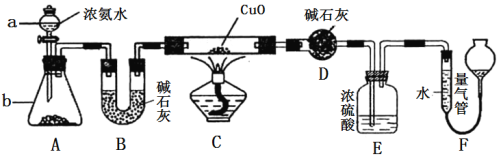
(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是 。
A.Cl2与饱和食盐水 B.CO2 与40%的NaOH溶液
C.NH3与饱和食盐水 D.HCl与水
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有________性,写出相应的化学方程式 。
(4)E装置中浓硫酸的作用________________________________。
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com