
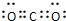 .
. 科目:高中化学 来源: 题型:推断题
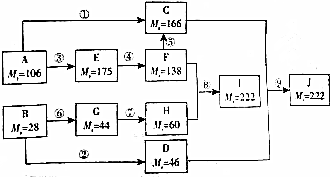
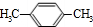 ,BCH2=CH2.
,BCH2=CH2.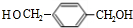 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$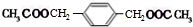 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时PbO2为正极,反应的离子方程式为:PbO2+4H++2e-+SO42-═PbSO4+2H2O | |
| B. | 充电时Pb电极为阴极,反应的离子方程式为:PbSO4+2e-═Pb+SO42- | |
| C. | 放电时电解质溶液密度不断减小,可根据电解液密度来判断是否需要充电 | |
| D. | 充电时可直接使用交流电源,不需要充电器也可充入 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | E(5s)>E(4f)>E(4s)>E(3d) | B. | E(4f)>E(3d)>E(4s)>E(3p) | C. | E(5d)>E(4d)>E(3d)>E(2d) | D. | E(5s)>E(4s)>E(4f)>E(3d) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜与氢氧化钡反应:Ba2++SO42-═BaSO4↓ | |
| B. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| C. | AlCl3溶液中滴加过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | 金属钠与水反应:2Na+2 H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
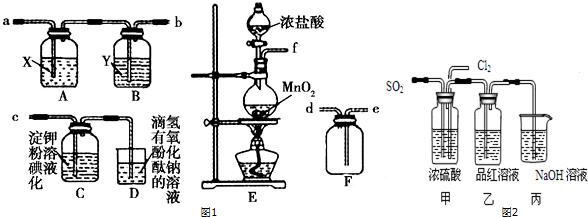
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
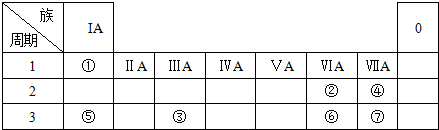
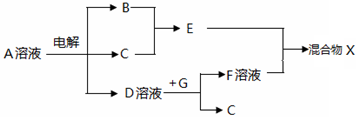
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.
(1)25℃时,pH=2的某酸HnA(A为酸根)与pH=12的某碱B(OH)m等体积混合,混合液的pH变为6.生成的正盐中存在着一定水解的离子,该离子水解的离子方程式为An-+H2O?HA(n-1)-+OH-.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
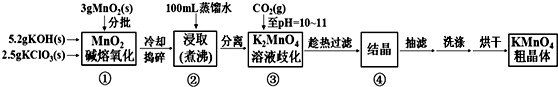
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com