
通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下面列举了一些化学键的键能数据,供计算使用。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)===Si(s)+4HCl(g),该反应的反应热ΔH为______。
科目:高中化学 来源: 题型:
主族元素A和B可组成为AB2的离子化合物,则A、B两原子的最外层电子排布式分别为( )
A.ns2np2和ns2np4 B. ns1和ns2np4
C.ns2和ns2np5 D.ns1和ns2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知XY2是红棕色气体,Z基态原子的M层与K层电子数相等。Y基态原子的电子排布式是__________________________;Z所在周期中第一电离能最大的主族元素是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是 ( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>①>③=②
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。

(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力,②形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:__________________________________________________。
②表中X可能为以上13种元素中的________(填写字母)元素,则该元素属于________区。用元素符号表示X和j所能形成的化合物的化学式是__________。
③Y是周期表中________族元素。
④以上13种元素中,________(填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,请写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
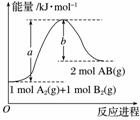
查看答案和解析>>
科目:高中化学 来源: 题型:
)已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1
H—H、O===O和O—H键的键能分别为436、496和462 kJ·mol-1,则a为( )
A.-332 B.-118
C.+350 D.+130
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式不正确的是( )
A.石英与烧碱反应:SiO2+2OH-===SiO +H2O
+H2O
B.硅与烧碱反应:Si+2OH-===SiO +H2↑
+H2↑
C.硅酸钠溶液中通入少量CO2:SiO +CO2+H2O===CO
+CO2+H2O===CO +H2SiO3↓
+H2SiO3↓
D.往水玻璃中加入盐酸:2H++SiO ===H2SiO3↓
===H2SiO3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com