
【题目】如图所示a、b都是惰性电极,通电一段时间后,a极附近溶液显红色。下列说法中正确的是( )
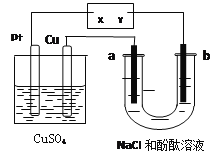
A. X是正极,Y是负极 B. U型管中溶液PH值逐渐变小
C. CuSO4溶液的pH逐渐减小 D. CuSO4溶液的pH保持不变
科目:高中化学 来源: 题型:
【题目】I. 已知:
反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数为K1;
FeO(s)+CO(g)的平衡常数为K1;
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g)的平衡常数为K2。
FeO(s)+H2(g)的平衡常数为K2。
在不同温度时K1、K2的值如下表:
温度(绝对温度) | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
(1)推导反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:___________,判断该反应是___________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)的平衡常数K与K1、K2的关系式:___________,判断该反应是___________反应(填“吸热”或“放热”)。
II. T1温度下,体积为 2L的恒容密闭容器,加入4.00molX,2.00molY,发生化学反应 2X(g)+Y(g)![]() 3M(g)+N(s) △H<0。部分实验数据如表格所示。
3M(g)+N(s) △H<0。部分实验数据如表格所示。
t/s | 0 | 500 | 1000 | 1500 |
n(X)/mol | 4.00 | 2.80 | 2.00 | 2.00 |
(2)前500s反应速率v(M)=____________,该反应的平衡常数K=_____________。
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_____。

a.Y的逆反应速率 b.M的体积分数
c.混合气体的平均相对分子质量 d.X的质量分数
(4)反应达到平衡后,若再加入3.00molM,3.00molN,下列说法正确的是_____。
A.平衡不移动
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00molX,2.00molY,则达平衡后M的物质的量浓度_____1.5mol/L(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、氟、钙、铜等元素的化合物广泛存在于自然界,回答下列问题:
(1)将乙炔(C2H2)通入[Cu(NH3)2]Cl溶液生成Cu2C2红榇色沉淀。乙炔分子中σ键与π键个数比值为___________,Cu+基态核外电子排布式为___________,[Cu(NH3)2]Cl中化学键类型为___________。
(2)NF3是微电子工业中优良的等离子刻蚀气体。元素第一电离能N___________F(填“>”“<”或“=”),NF3中氮原子的杂化轨道类型为___________,NF3属于___________分子。(填“极性”或“非极性”)
(3)C60可以用作储氢材料。已知金刚石中C-C的键长为154.45pm,C60中C-C的键长为140~145pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?理由是___________。
(4)氮的氧化物和含氧酸在医疗上具有重要的应用。写出与N2O互为等电子体的分子___________(任写一种),酸性HNO3>HNO2,试着从结构上解释其原因___________。
(5)电石(CaC2)是有机合成化学工业的基本原料。CaC2晶体的晶胞结构与NaCl晶体相似(如图所示),但晶体中由于哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中每个Ca2+周围距离最近的C22-的数目为___________,已知CaC2晶体的密度为2.22g·cm-3,该晶胞的体积为___________cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,有pH值为12的NaOH溶液100 mL,欲将其pH值变为11,采取下列三种措施(设混合后溶液的体积等于两混合溶液体积之和)。请回答有关问题:
①若加水,应加入约________ mL。
②若用pH=10的NaOH溶液,应加入此NaOH溶液________ mL。
③若用pH=2的盐酸,应加入________ mL。
(2)pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL, 其pH的变化如图所示

①稀释前两溶液的浓度c(HA)________c(HB)(填>.<.=,或无法确定)
② HB _______ 是弱酸 (填“一定”、“可能”或“一定不”)
③若 a = 5,则HA酸是否是强酸 ____(填“一定是”、“可能是”、 “一定不是”或“无法确定”)
④稀释后的溶液中,由水电离产生的c(H+): HA中_____ HB中(填>.<.=,或无法确定)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】螺环化合物具有抗菌活性,用其制成的药物不易产生抗药性,螺[3,4]辛烷的结构如图,下列有关螺[3,4]辛烷的说法正确的是( )

A. 分子式为C8H16B. 分子中所有碳原子共平面
C. 与2—甲基—3—庚烯互为同分异构体D. 一氯代物有4种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(?)![]() 2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )
2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )
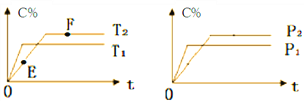
A. E点的v(逆)大于F点的v(正)
B. 若在F点时给容器加压,达新平衡时C的浓度将增大
C. 若给容器加热,该反应的平衡常数K将增大
D. 恒温恒容下达平衡后,向容器中再加入2molA和1molB,A的转化率不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是前20号元素中的常见元素,且核电荷数递增。A原子没有中子;B原子次外层电子数与最外层电子数之差等于电子层数;C元素是地壳中含量最高的元素;4.6gD单质与足量盐酸作用可产生2.24LH2(标准状态下);E的一价阴离子的核外电子排布与Ar的核外电子排布相同。请回答下列问题:
(1)写出A、B、D的元素符号:A____;B_____;D_____。
(2)C离子的电子式_____;E的离子结构示意图_____;
(3)实验室里检验E的单质常用的试剂是____;
(4)写出电解D、E形成化合物的水溶液的化学反应方程式_____;
(5)写出由A、B、C、D形成的化合物与由A、C、E形成的化合物发生反应的化学反应方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某同学设计如下实验方案:

(1)操作①为______。
(2)操作②~④加入的试剂可以为____________。
(3)如何判断SO42-已除尽,简述实验操作____________。
(4)该同学设计的实验方案______(填“合理”或“不合理”),理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是:__________

(2)实验室制备氯气时要在通风橱内完成,并且为了防止氯气污染空气,要有尾气处理装置,一般用_________溶液吸收多余的氯气,原理是(用化学方程式表示)_________________
(3)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,反应的化学方程式是__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com