
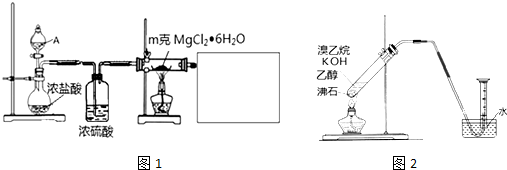
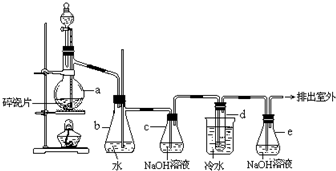
分析 (1)加热氯化镁晶体失去结晶水得到无水氯化镁,由于氯化镁易水解,应在HCl氛围中加热分解,A中液体为浓硫酸,与圆底烧瓶中浓盐酸混合,发生大量的热,利用HCl逸出,洗气瓶中浓硫酸干燥HCl,利用氢氧化钠溶液吸收尾气中HCl,防止污染空气,注意防止倒吸,还要防止氢氧化钠溶液中水蒸气导致氯化镁水解,尾气处理装置与加热装置之间需要连接盛放氯化钙的干燥管(或盛放浓硫酸的洗气瓶);
③称量加热后固体的质量可以判断氯化镁晶体是否完全分解;
④电解熔融氯化镁生成Mg单质,Mg元素发生还原反应,应电解池阴极析出;
(2)①乙醇在浓硫酸作用下发生消去反应生成乙烯,反应中会发生副反应,有二氧化碳、二氧化硫生成,用氢氧化钠溶液吸收除去二氧化碳、二氧化硫,液体加热需要防止暴沸,还需要加入沸石;
②方案中利用溴乙烷发生消去反应生成乙烯,利用图中装置制备乙烯,实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,说明生成乙烯很少,大量的溴乙烷挥发,可以可以增加冷凝回流装置,有利于溴乙烷冷凝回流,可以利用水浴加热控制反应温度,减少溴乙烷挥发,反应会生成HBr,HBr极易溶于水,利用排水法收集乙烯,会发生倒吸.
解答 解:(1)加热氯化镁晶体失去结晶水得到无水氯化镁,由于氯化镁易水解,应在HCl氛围中加热分解,A中液体为浓硫酸,与圆底烧瓶中浓盐酸混合,发生大量的热,利用HCl逸出,洗气瓶中浓硫酸干燥HCl,利用氢氧化钠溶液吸收尾气中HCl,防止污染空气,注意防止倒吸,还要防止氢氧化钠溶液中水蒸气导致氯化镁水解,尾气处理装置与加热装置之间需要连接盛放氯化钙的干燥管(或盛放浓硫酸的洗气瓶);
①由上述分析可知,分液漏斗中的A物质是浓硫酸,故答案为:浓硫酸;
②利用氢氧化钠溶液吸收尾气中HCl,防止污染空气,且防止倒吸,还要在尾气处理装置与加热装置之间需要连接盛放氯化钙的干燥管(或盛放浓硫酸的洗气瓶),防止氯化镁水解,需要补充完整实验装置(不必画出夹持装置)为: 等,
等,
故答案为: 等;
等;
③实验过程中MgCl2?6H2O未水解,mg晶体的物质的量为$\frac{\\;m}{203}$mol,完全分解得到氯化镁为$\frac{m}{203}$mol×95g/mol=$\frac{95m}{203}$g,称量所得产物质量,若质量为$\frac{95m}{203}$g,说明MgCl2?6H2O完全转化为MgCl2,否则未完全,
故答案为:称量所得产物质量,若质量为$\frac{95m}{203}$g,说明MgCl2?6H2O完全转化为MgCl2,否则未完全;
④电解熔融氯化镁生成Mg单质,Mg元素发生还原反应,应电解池阴极析出,
故答案为:阴;
(2)①乙醇在浓硫酸作用下发生消去反应生成乙烯,反应中会发生副反应,有二氧化碳、二氧化硫生成,用氢氧化钠溶液吸收除去二氧化碳、二氧化硫,液体加热需要防止暴沸,还需要加入沸石,除乙醇外,所需的试剂或用品(不包括仪器)有:浓硫酸、氢氧化钠溶液、沸石,
故答案为:浓硫酸、氢氧化钠溶液、沸石;
②方案中利用溴乙烷发生消去反应生成乙烯,利用图中装置制备乙烯,实验结果是量筒内壁附着较多无色油状液体,且得到很少量的气体,说明生成乙烯很少,大量的溴乙烷挥发,
气体产率很低的原因主要是:加热温度过高,溴乙烷大量挥发,也可能是溴乙烷发生副反应等;
为增大气体产率,可以增加冷凝回流装置,有利于溴乙烷冷凝回流,可以利用水浴加热,便于控制温度等,减少溴乙烷挥发;
反应会生成HBr,HBr极易溶于水,用排水法收集乙烯,从实验安全角度考虑,该实验很可能发生的问题是:容易发生倒吸,
故答案为:加热温度过高,溴乙烷大量挥发,也可能是溴乙烷发生副反应等;增加冷凝回流装置等;容易发生倒吸.
点评 本题考查化学实验制备,属于拼合型题目,明确制备原理是解题关键,侧重考查学生对原理、装置、操作的分析评价,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 新装修的房子应该开窗、通风一段时间后再入住 | |
| B. | 制作家具用的固化剂等化学试剂越多越好 | |
| C. | 饮用的水越纯净越健康 | |
| D. | 旧电池已不能使用,不需要回收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
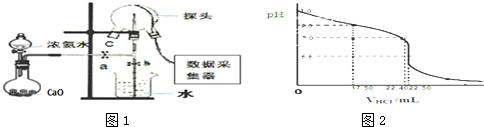
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
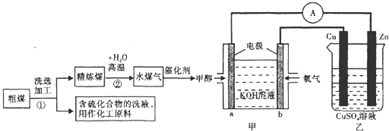
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二次平衡时,Z的浓度为0.2 mol•L-1 | |
| B. | m=3 | |
| C. | X与Y的平衡转化率之比为1:2 | |
| D. | 加入Z后平衡没移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com