
某溶液可能含有Al3+、NH4+、Fe2+、Na+、CO32-、SO42-、Cl-、NO3-中的若干种。若在该溶液中逐滴加入稀盐酸至过量无明显现象,并得到X溶液,对X溶液进行如下实验:(已知该题忽略水的电离,且原溶液中各离子浓度均为0.5mol•L-1)

下列结论正确的是
A.原溶液中可能含有NO3-和Al3+
B.白色沉淀C可能是Al(OH)3
C.原溶液中一定存在NH4+、Fe2+、SO42-、Cl-
D.沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2016届山东省滕州市高三上学期10月月考化学试卷(解析版) 题型:选择题
一定条件下存在反应:C(s)+H2O(g)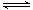 CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
容器 | 甲 | 乙 |
|
容积 | 0.5 L | 0.5 L | V |
温度 | T1 ℃ | T2 ℃ | T1 ℃ |
起始量 | 2 molC1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V < 0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1 < T2
查看答案和解析>>
科目:高中化学 来源:2016届山东省南校区高三上学期10月阶段测化学试卷(解析版) 题型:选择题
下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效:ClO- + CO2 + H2O ==== HClO + HCO3-
B.用浓盐酸与MnO2反应制取少量氯气:
MnO2+2H++2Cl-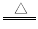 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
C.向Na[Al(OH)4]溶液中通入过量CO2制Al(OH)3∶
[Al(OH)4]- + CO2 ==== Al(OH)3↓ + HCO3-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3====2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南洛阳高级中学高二上9月月考化学试卷(解析版) 题型:选择题
21世纪人类正由“化石能源时代”逐步向“多能源时代”过渡,下列不属于新能源的是
A.太阳能 B.核能 C.氢能 D.电力
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期第三次月考化学试卷(解析版) 题型:选择题
将一定量的铁粉完全溶解于某浓度的硝酸中,反应后收集到NO2和NO的混合气体,下列说法正确的是
A.反应后生成的盐只有Fe(NO3)2
B.反应后生成的盐只有Fe(NO3)3
C.反应后生成的盐为Fe(NO3)2和Fe(NO3)3
D.以上三种情况都有可能
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷(解析版) 题型:填空题
(10分)
如右图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol·L-1。经过 60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)

(1)容器中气体出现红棕色的原因(用化学方程式表示)是: 。
(2)前 2s内乙容器中以N2O4的浓度变化表示的反应速率为 。
(3)达到平衡时,甲容器中反应所需的时间 60s(填“大于”、“小于”或“等于”,下同);容器内N2O4的浓度甲 乙;反应过程中吸收的能量甲 乙。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷(解析版) 题型:选择题
已知下列两个热化学方程式
2H2(g)+ O2(g)===2H2O(l)△H = -571.6kJ·mol-1
C3H8(g)+5O2(g)=== 3CO2(g)+ 4H2O(l)△H = -2 220.0kJ·mol-1
实验测得氢气和丙烷的混和气体共5 mol完全燃烧时放热3847kJ,则混和气体中氢气与丙烷的体积比是
A.1:3 B.3:1 C.1:4 D.1:1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下表中是各组反应的反应物和温度,反应刚开始时,放出H2速率最快的是
金属(粉末状)(mol) | 酸的浓度及体积 | 反应温度(℃) | |
A | Mg 0.1 | 0.1 6 mol·L-1硝酸10mL | 80 |
B. | Mg 0.1 | 0.1 3 mol·L-1盐酸10mL | 60 |
C. | Fe 0.1 | 0.1 3 mol·L-1盐酸10mL | 60 |
D. | Mg 0.1 | 0.1 3 mol·L-1硫酸10mL | 60 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上期中考试化学试卷(解析版) 题型:选择题
下列混合溶液中,各离子浓度的大小顺序正确的是
A.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10 mL0.1mol/LNH4Cl溶液与5 mL0.2mol/LNaOH溶液混合:
c(Na+)= c(Cl-)>c(OH-)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合:
(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合:
c(Cl-)> c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com