
【题目】短周期元素X、Y、Z、M 在周期表中的位置关系如右图,对这些元素形成的单质或化合物推测正确的是( )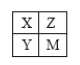
A.若Z元素形成的单质是Z2,则M元素形成的单质也一定是M2
B.若HnX常温下是气体,则HmZ 常温下也是气体
C.若有碱M(OH)n,则也一定有碱Y(OH)m
D.若Y有最高价含氧酸HnYOm,则X也一定有最高价含氧酸HnXOm
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.少量SO2通入BaCl2溶液中:![]()
B.![]() 与足量盐酸反应:
与足量盐酸反应:![]()
C.![]() 中加入
中加入![]() 酸化的KMnO4:
酸化的KMnO4:![]()
D.向NaClO和NaCl混合溶液中滴入少量FeSO4溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是( )
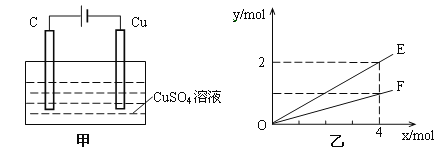
A. E表示生成铜的物质的量
B. E表示反应消耗水的物质的量
C. F表示反应生成氧气的物质的量
D. F表示生成硫酸的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究SO2、NOx等大气污染物的要善处理具有重要意义。
(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g)对煤进行脱硫处理。某温度下,测得反应在不同时间点各物质的浓度如下:
2CaSO4(s)+2CO2(g)对煤进行脱硫处理。某温度下,测得反应在不同时间点各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.78 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.44 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(SO2)=___mol/(L·min)。
②30min后,只改变某—条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___(填字母)。
A.移除部分CaSO4(s) B.通入一定量的O2
C.加入合适的催化剂 D.适当缩小容器的体积
(2)利用活性炭吸附汽车尾气中的NO:C(s)+2NO(g)![]() N2(g)+CO2(g),实验测得,v正=k正c2(NO),v逆=k逆c(N2) c(CO2)(k正、k逆为速率常数,只与温度有关)。在密闭容器中加入足量C(s)和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g),实验测得,v正=k正c2(NO),v逆=k逆c(N2) c(CO2)(k正、k逆为速率常数,只与温度有关)。在密闭容器中加入足量C(s)和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
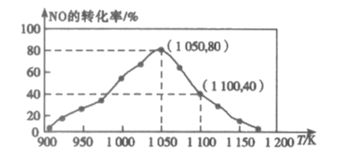
①由图可知:该反应的ΔH___0(填“>”或“<”);在1050K前反应中NO的转化率随温度升高而增大,其原因为___。
②用某物质的平街分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,计算该反应的化学平衡常数Kp=___[已知:气体分压(P分)=气体总压(P×体积分数]。
③达到平衡后,仅升高温度,k正增大的倍数___(填“>”、“<”或“=”)k逆增大的倍数,1100K时,计算k正:k逆=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应能发生并用于化工生产的是()
A.制盐酸:Cl2+H2![]() 2HCl
2HCl
B.制取镁:MgCl2(溶液)![]() Mg+Cl2
Mg+Cl2
C.制乙烯:C2H5OH![]() CH2=CH2+H2O
CH2=CH2+H2O
D.制乙醇:CH2=CH2+H2O![]() C2H5OH
C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是实验室里常用的一种化学试剂,请回答下列问题:
(1)在实验室里,取用沉浸在煤油中的金属钠的操作方法是__________________。
(2)在空气中切开一块金属钠,可看到断面呈________色,具有金属光泽,但断面很快变____________,主要是由于生成一薄层____________。
(3)若把钠放在石棉网上加热可观察到____________________________________,反应的化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
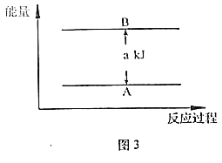
【题目】在25℃、101kPa的条件下,断裂1 molH—H键吸收436 kJ能量,断裂1mol Cl—Cl键吸收243kJ能量,形成1 molH—Cl键放出431 kJ能量。
H2+Cl2===2HCl的化学反应可用如图表示:
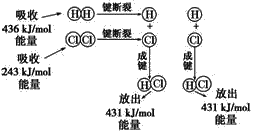
请回答下列有关问题:
(1)反应物断键吸收的总能量为____。
(2)生成物成键放出的总能量为____。
(3)1molH2和1molCl2反应生成2molHCl是_____(填“吸收”或“放出”)能量的反应,其能量值为____。
(4)反应物总能量___(填“>”或“<”)生成物总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为应对全球气候变暖,科学家在综合利用 CO2 方面取得了不少研究成果。如用 CO2 合成重要化工原料 CH3OH,同时生成 CO,反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+Q1kJ(Q1>0),
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g)-Q2kJ(Q2>0)。
研究催化剂等外界条件对上述反应的影响,结果如图 1、图 2
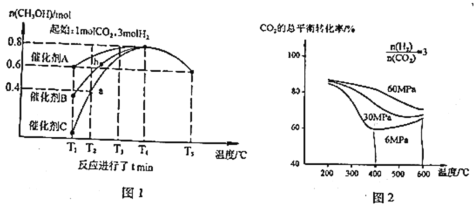
完成下列填空:
(1)一定是碳12的同位素原子是_____(选填“A”、“B”、“C”、“D”)
A.质子数为6,中子数为8 B.质子数为8,中子数为12
C.质子数为12,中子数为6 D.质子数为12,中子数为8
(2)分析图1:催化效果最佳的是催化剂_____(选填“A”、“B”、“C”)。若密闭容器体积为2L,则a点测得CH3OH的平均生成速率为_____mol·L-1·min-1。b点反应_____(填“达到”或“未达到”)平衡状态,理由是:_____
(3)分析图2:相同温度下,增大原料气压强,反应Ⅰ平衡常数_____(选填“增大”、“减小”、“不变”、“无法判断”);当压强为6Mpa、温度在400~600℃时,CO2的总体平衡转化率随温度升高而增大的原因是___________________________________
(4)若生成的CH3OH和CO物质的量之比为4:1,则消耗相同条件下的CO2和H2体积比是_____
(5)若有88gCO2发生反应Ⅰ,并放出akJ热量,则图3中A为_____,B为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积相同的两个容器中,充入等质量CO2和CO气体,下列判断正确的是( )
A.CO2和CO对容器产生的压强之比是7∶11
B.CO2和CO的密度之比是11∶7
C.CO2和CO的分子数相等
D.CO2和CO的氧原子个数比是22∶7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com