
能正确表示下列反应的离子方程式为 ( )
A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO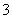 +OH-===CO
+OH-===CO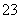 +H2O
+H2O
B.二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-===SO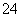 +Cl-+H2O
+Cl-+H2O
C.硫化钡加入稀硫酸:BaS+2H+===H2S↑+Ba2+
D.在强碱溶液中次氯酸钠与F e(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3===2FeO
e(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3===2FeO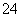 +3Cl-+H2O+4H+
+3Cl-+H2O+4H+
科目:高中化学 来源: 题型:
化学与能源、环境、生产、生活密切相关.下列说法不正确的是( )
|
| A. | CO2和氟氯烃等物质的大量排放会造成温室效应的加剧 |
|
| B. | 可利用工业生产产生的二氧化碳制造全降解塑料 |
|
| C. | 世博会很多场馆的外壳使用非晶硅薄膜,以充分利用太阳能,体现低碳经济 |
|
| D. | 用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,但无净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质在指定条件下电离方程式正确的是 ( )
A.Na2CO3溶于水 Na2CO3===Na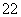 +CO
+CO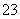
B.Al(OH)3酸式电离 Al(OH)3===H++AlO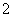 +H2O
+H2O
C.NaHS溶于水HS-的电离 HS-+H2O H2S+OH-
H2S+OH-
D.NaHCO3加热熔化 NaHCO3===Na++HCO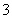
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )
A.向水中通入氯气:Cl2+H2O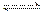 2H++Cl-+ClO-
2H++Cl-+ClO-
B.向氯化铁溶液中加入铜:2Fe3++3Cu===2Fe+3Cu2+
C.NH4HCO3溶液与过量KOH浓溶液共热:NH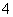 +OH-
+OH-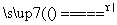 NH3↑+H2O
NH3↑+H2O
D.向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-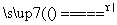 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl |
分别取四种物质进行实验,实验结果如下①B溶液分别与C、D混合,均有白色沉淀生成②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体
回答下列问题:
(1)A所含的阳离子和C所含阳离子的半径大小_▲___>___▲___(填离子符号)。B所含的阴离子是____▲____
(2)C溶液呈__▲_性(填“酸性”或“碱性”),其原因是______▲____________
(用离子方程式解释)。D的化学式是_____▲_______
(3)以Pt为电极电解1L0.1mol/LB的水溶液,当电路中通过0.1mol电子时,
溶液的pH为___▲____(设电解过程溶液体积不变),阳极的电极反应式为 ___▲__
(4)若将④阳极产生的气体通入A溶液中至恰好完全反应时,则溶液中各离子
浓度由大到小的排列顺序为____________▲______________
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下;下列各组离子在指定溶液中一定能大量共存的是( )。
A.0.1 mol·L-1 NaOH溶液:K+、Na+、S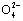 、C
、C
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、N 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、N 、I-、SCN-
、I-、SCN-
D.c(H+) /c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、N
/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、N
查看答案和解析>>
科目:高中化学 来源: 题型:
酒后驾车。这时酒精(CH3CH2OH)被K2Cr2O7氧化为醋酸(CH3COOH)。该氧化还原反应的方程式可表示为:2K2Cr2O7+3CH3CH2OH+8H2SO4→2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O ;在这一反应中,氧化剂是  ,还原剂________,氧化产物是 ,还原产物是 。
,还原剂________,氧化产物是 ,还原产物是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 :
(2)过程I 加入铁屑的主要作用是 ,分离得到固体的主要成分是 ,从固体中分离出铜需采用的方法是 ;
(3)过程II中发生反应的化学方程式为 ;
(4)过程II中调节溶液的pH为5,金属离子浓度为 。(列式计算)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com