
| 选项 | 实验操作 | 实验目的 |
| A | 在ZnS的白色浊液中滴几滴CuSO4溶液 | 探究Ksp(ZnS)和Ksp(CuS)的相对大小 |
| B | 用pH试纸分别测定等浓度的NaF、NaClO溶液的pH | 探究HF与HClO的电离常数 |
| C | 取少量硝酸亚铁溶液,滴加盐酸和KSCN溶液 | 探究硝酸亚铁是否变质 |
| D | 在CH2=CHCH2OH中滴加酸性高锰酸钾溶液,振荡 | 检验丙烯醇是否具有碳碳双键 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.ZnS和CuS的类型相似,可以根据生成沉淀的颜色判断Ksp(ZnS)和Ksp(CuS)的相对大小;
B.NaClO具有强氧化性,不能用pH试纸测定NaClO溶液的pH;
C.硝酸根离子在酸性条件下能够氧化亚铁离子,不能加入盐酸;
D.酸性高锰酸钾具有强氧化性,能够氧化羟基.
解答 解:A.在ZnS的白色浊液中滴几滴CuSO4溶液,白色沉淀转化成黑色,证明Ksp(ZnS)>Ksp(CuS),该方法浓度达到实验目的,故A正确;
B.由于次氯酸钠具有强氧化性,能够漂白试纸,所以不能用pH试纸沉淀次氯酸钠的pH,故B错误;
C.硝酸根离子在酸性条件下具有强氧化性,能够氧化亚铁离子,所以即使硝酸亚铁没有变质,溶液也显示红色,不能加入盐酸,故C错误;
D.CH2=CHCH2OH中含有碳碳双键和羟基,由于酸性高锰酸钾溶液能够氧化羟基,所以干扰了碳碳双键的检验,应该用溴水检验碳碳双键,故D错误;
故选A.
点评 本题考查了性质实验方案的设计与评价,题目难度中等,明确常见物质的性质及检验方法为解答关键,注意掌握难溶物溶度积的概念及应用,B为易错点,注意次氯酸钠检验强氧化性.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中逐滴滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| B. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 硫化钠发生水解:S2-+2H2O═H2S+2OH- | |
| D. | 向NH4HSO4溶液中加入NaOH溶液至混合液呈中性:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内质子数为15的元素的最高正价为+3 | |
| B. | 电子层数相同时,最外层7个电子的元素非金属性最强 | |
| C. | 原子序数从11依次增加到17,原子半径逐渐增大 | |
| D. | 随着原子序数的增加,元素原子最外层电子数逐渐增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C$\stackrel{在空气中点燃}{→}$CO$\stackrel{CuO,△}{→}$CO2$\stackrel{NaOH溶液}{→}$Na2CO3 | |
| B. | Cu$\stackrel{AgNO_{3}溶液}{→}$Cu(NO3)2$\stackrel{NaOH溶液}{→}$Cu(OH)2 | |
| C. | Fe$\stackrel{点燃}{→}$Fe2O3$\stackrel{H_{2}SO_{4}溶液}{→}$Fe2(SO4)3溶液 | |
| D. | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2溶液$\stackrel{Na_{2}CO_{3}}{→}$NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
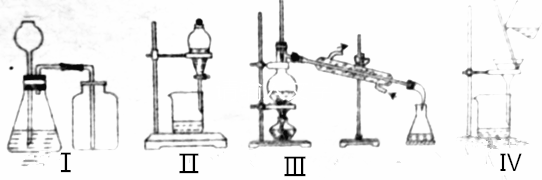
| A. | 选择装置Ⅰ用铜与浓硝酸反应制备NO2 | |
| B. | 选择装置Ⅱ分离乙酸乙酯和饱和碳酸氢钠溶液的混合物 | |
| C. | 选择装置Ⅲ分离对硝酸甲苯和邻硝基甲苯 | |
| D. | 选择装置Ⅳ分离饱和硫代硫酸钠溶液和硫代硫酸钠晶体的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.5mol/(L•min) | B. | υ(B)=1.2mol/(L•s) | C. | υ(C)=1mol/(L•s) | D. | υ(D)=2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
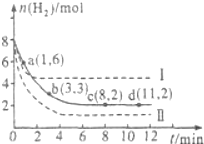 工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com