
【题目】下列说法正确的是( )
A. H2、D2互为同位素
B. CH3CH2CH2CH2CH3和CH3CH2CH(CH3)2互为同素异形体
C. 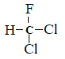 和
和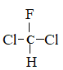 为同一物质
为同一物质
D. CH3CH2OH和CH2OHCHOHCH2OH具有相同的官能团,互为同系物
【答案】C
【解析】A.质子数相同中子数不同的同一种元素的不同核素互为同位素;
B.由同一种元素形成的不同单质互为同素异形体;
C.根据甲烷是正四面体结构分析;
D.结构相似,分子组成相差若干个CH2原子团的有机物互为同系物。
A.H2、D2均表示氢气分子,不能互为同位素,A错误;
B.CH3CH2CH2CH2CH3和CH3CH2CH(CH3)2的分子式相同,结构不同,互为同分异构体,B错误;
C.甲烷是正四面体结构,分子中的四个氢原子完全相同,所以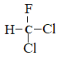 和
和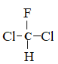 为同一物质,C正确;
为同一物质,C正确;
D.CH3CH2OH和CH2OHCHOHCH2OH具有相同的官能团,但羟基个数不同,不能互为同系物,D错误。
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作、实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 将乙烯分别通入溴水和酸性高锰酸钾溶液 | 溶液均褪色 | 二者反应类型相同 |
B | 对于密闭烧瓶中的已达到平衡的可逆反应:2NO2 | 混合气体颜色变深 | 加热该化学平衡可向正向移动 |
C | 某溶液中加入新制氢氧化铜悬浊液,加热 | 有砖红色沉淀生成 | 该溶液一定是葡萄糖溶液 |
D | 甲烷和氯气混合气体充入大试管中,倒立在水槽里,置于光亮处,过一段时间后,将试管从水槽中取出,向其中滴入几滴石蕊溶液 | 溶液变红 | 甲烷和氯气反应产物中有氯化氢 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质分类和胶体的叙述.下列有关物质的分类说法正确的是
A.金属氧化物一定是碱性氧化物
B.胶体和其他分散系的本质区别是分散质粒子大小不同
C.生石灰、醋酸、纯碱、氯化钠对应的物质类别是氧化物、酸、碱、盐
D.酸性氧化物一定是非金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量.下列表示氢氧化钠加入量(x)与溶液中沉淀的量(y)的关系示意图中正确的是( )
A.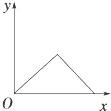
B.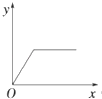
C.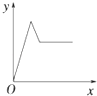
D.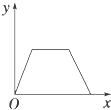
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40mL物质的量浓度为0.05molL-1Na2SO3溶液恰好与25mL浓度为0.02molL-1的K2X2O6溶液完全反应,已知Na2SO3可被K2X2O6氧化为Na2SO4,则元素X在还原产物中的化合价为下列的
A.+1价B.+2价C.+3价D.+4价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由芳香烃X合成一种功能高分子H的过程如下。(部分产物、合成路线、反应条件略去)。
其中A是一氯代物,H的链节组成为C7H5NO
已知:I芳香烃X用质谱仪测出的质谱图如图所示
请根据所学知识与本题所给信息回答下列问题
(1)H的结构简式是_____________;(2)反应③和④的类型分别是_____________、_____________
(3)反应⑤的化学方程式是__________________________
(4)阿司匹林中含氧官能团的名称为__________________________
(5) 的一种同系物
的一种同系物 有多种同分异构体,其中符合下列要求的共有_____________种(不考虑立体异构),写出其中核磁共振氢谱为6组峰,且峰面积比为2:2:2:2:1:1的结构简式_____________
有多种同分异构体,其中符合下列要求的共有_____________种(不考虑立体异构),写出其中核磁共振氢谱为6组峰,且峰面积比为2:2:2:2:1:1的结构简式_____________
①能与 NaHCO3反应放出CO2
②能与FeCl3溶液发生显色反应
③苯环上的一取代物有两种
(6)请用合成反应流程图表示出由A和其他无机物合成 最合理的方案。_______________
最合理的方案。_______________
例:  。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵品体[(NH4)2Fe(SO4)2·6H2O]又称摩尔盐,是一种重要的化工原料,用途十分广泛。
(1)基态Fe2+的核外电子排布式为_____________________。
(2)氨是合成摩尔盐的重要原料,工业合成氨中,原料气在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收其中的杂质CO气体,其反应方程式为:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)](Ac-=CH3COO-)
[Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)](Ac-=CH3COO-)
①醋酸中碳原子的杂化方式是_________,1mol乙酸分子中含有σ键的数目为_________________。
②C、N、O三种元素的第一电离能由小到大的顺序为___________________________。
③与CO互为等电子体的分子为___________(填化学式),NH3的空间构型为__________________。
(3)N和P都是第VA族元素,其最简单氢化物熔点的大小关系为_________,主要原因是__________________________________。
(4)铁在不同温度范围有不同的晶体结构。室温下铁是简单立方,称为α铁(α-Fe)。当温度升高到912℃,α铁转变为面心立方,称为γ铁(γ-Fe)。当温度继续升高到1394 ℃,γ铁转变为体心立方。称为δ铁(δ-Fe)。

①γ铁晶体中铁原子配位数是____________________。
②δ铁晶体密度为dg·cm-3,则其晶胞参数(边长)为__________cm(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
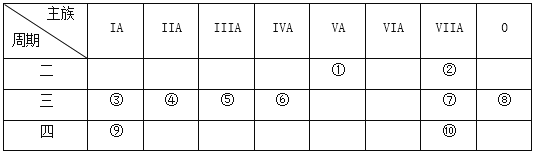
(1)在③~⑦中元素,原子半径最大的是_____________,其离子的结构示意图是__________________。
(2)表中的①~⑩中元素,非金属性最强的是_______,化学性质最稳定的是________,金属性最强的是__________,最高价氧化物的水化物的酸性最强的是(写该水化物的化学式)______________。
(3)⑦的氢化物的水溶液与①的氢化物的水溶液反应的离子方程式为___________________________。
(4)用一个化学反应说明⑦比⑩的单质化学性质活泼,写出反应的化学方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com