
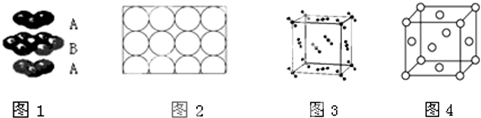
| A. | 钛和钾都采取图1的堆积方式 | |
| B. | 图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积 | |
| C. | 图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围最近且等距离的CO2有8个 | |
| D. | 图4是一种金属晶体的晶胞,它是金属原子在三维空间以密置层采取ABCABC…堆积的结果 |
分析 A.根据图1判断紧密堆积方式判断;
B.在二维空间里的非密置层放置,在三维空间堆积形成A2型紧密堆积,据此判断;
C.判断晶胞类型,根据配位数判断;
D.根据晶胞类型判断密置层堆积方式.
解答 解:A.图1表示的堆积方式为A3型紧密堆积,K采用A2型紧密堆积,故A错误;
B.在二维空间里的非密置层放置,在三维空间堆积形成A2型紧密堆积,得到体心立方堆积,故B错误;
C.干冰晶体的晶胞属于面心立方晶胞,配位数为12,即每个CO2周围距离相等且为$\frac{\sqrt{2}}{2}$acm的CO2有12个,故C错误;
D.该晶胞类型为面心立方,则堆积方式为A1型密堆积,即金属原子在三维空间里以密置层采取ABCABC…堆积,故D正确;
故选D.
点评 本题考查晶体结构的堆积模型和晶胞结构,难度不大,要牢固掌握基础知识.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 44 g CO2 气体中含有原子数为2NA | |
| B. | 常温常压下22.4 L H2 中含原子数为2NA | |
| C. | 64g二氧化硫含有原子数为3NA | |
| D. | 标准状况下22.4 L H2O中含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图,B的最外层电子数比K层电子多1,D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:
A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图,B的最外层电子数比K层电子多1,D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子中三个碳原子在同一条直线上 | |
| B. | 丙烯可使酸性高锰酸钾溶液褪色 | |
| C. | 丙烯可使溴水褪色 | |
| D. | 丙烯能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
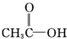 )和羟基乙醛(
)和羟基乙醛(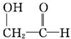 )互为同分异构体.
)互为同分异构体.| A. | ③④ | B. | ②③ | C. | ①③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Al3+、OH-、Cl- | B. | H+、Mg2+、NO3-、SiO32- | ||
| C. | Fe3+、NH4+、SCN-、F- | D. | Na+、Cu2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途.
第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途.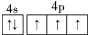 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com