
【题目】为充分利用资源,变废为宝,实验室里利用废铁屑制取硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]。某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O4·2H2O),进一步制备高纯度还原铁粉。

已知:FeC2O4·2H2O难溶于水,150℃开始失结晶水;H2C2O4易溶于水,溶解度随温度升高而增大。请回答下列问题:
(1)步骤②中,H2C2O4稍过量的主要原因是________。
(2)为了提高步骤③得到的FeC2O4·2H2O的纯度,宜用________(填“热水”“冷水”或“无水乙醇”)洗涤,检验洗涤是否干净的操作是________。
(3)实现步骤④必须用到的两种仪器是________(供选仪器:a. 烧杯;b. 坩埚;c. 蒸馏烧瓶;d. 高温炉;e. 表面皿;f. 锥形瓶)。
(4)为实现步骤⑤,不宜用碳粉还原Fe2O3,理由是________。
(5)硫酸亚铁铵是重要的工业原料,其溶解性如表所示:
10 | 20 | 30 | 40 | 50 | 60 | |
(NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | — | — |
(NH4)2Fe(SO4)2·6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
(注意:高于73.3℃,FeSO4·7H2O发生分解)
以铁屑(有油污)、硫酸、硫酸铵为原料,补充制取硫酸亚铁铵晶体的实验方案:将铁屑置于锥形瓶中,______,冷却,过滤,用蒸馏水洗涤铁屑至中性,将铁屑置于锥形瓶中,_____至铁屑完全溶解,_____,冷却结晶,用无水乙醇洗涤2~3次,低温干燥。[实验中必须使用的试剂:铁屑、1.0 mol·L-1的Na2CO3溶液、3.0 mol·L-1的H2SO4溶液,饱和(NH4)2SO4溶液]
【答案】使Fe2+反应更加充分,提高其转化率 热水 取最后一次洗涤溶液少许,向其中加入盐酸酸化的氯化钡,若无白色沉淀,则洗涤干净 bd 反应接触不充分或者有C杂质 加入1.0 mol·L-1的Na2CO3溶液,加热煮沸后 边搅拌边加入3.0 mol·L-1的H2SO4溶液 加入一定量的饱和(NH4)2SO4溶液,低于73.3 ℃水浴加热,将溶液浓缩到表面有晶膜出现
【解析】
(1)硫酸亚铁铵中的Fe2+发生水解,加入稍过量的草酸有助于抑制Fe2+的水解,使反应更加充分,提高草酸亚铁的转化率;
(2)已知草酸在水中的溶解度随温度的升高而增大,第三步洗涤过程中应用热水,以保证附着在草酸亚铁表面的杂质全部洗净;检验洗涤是否干净的操作过程为:取最后一次洗涤溶液少许,向其中加入盐酸酸化的氯化钡,若无白色沉淀,则洗涤干净;
(3)步骤4为高温反应,所以应选用bd两种仪器;
(4)利用碳粉还原氧化铁,可能会出现反应不均、生成的Fe中有C杂质混入等情况;
(5)加入1.0 mol·L-1的Na2CO3溶液有助于洗去铁屑表面的油污;加入3.0 mol·L-1的H2SO4溶液可以将铁屑反应生成硫酸亚铁;加入饱和(NH4)2SO4溶液直至有晶膜出现保证硫酸亚铁和硫酸铵可以同时析出生成硫酸亚铁氨,反应出超过73.3℃是为了防止FeSO4·7H2O失水。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】下列各有机物的数目与分子式C4H7ClO2且能与NaHCO3溶液反应生成CO2的有机物的数目(不考虑立体异构)相同的是
A.分子式为C5H10的烯烃B.甲苯的一氯代物
C.相对分子质量为74的一元醇D.立方烷(![]() )的二硝基取代物
)的二硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾和碘的相关化合物在化工医药材料等领域有广泛的应用。回答下列问题:
(1)基态K原子中,核外运动状态不同的电子共________种,占据最高能级的电子的电子云轮廓图形状为________。
(2)K和Cr属于同一周期,且核外最外层电子构型相同。第一电离能比较:K________(填“>”或“<”)Cr,金属键强度比较:K________(填“>”或“<")Cr.
(3)IO3-离子的立体构型的名称为________,中心原子的杂化方式为________.
(4)HIO4的酸性强于HIO3,其原因为________
(5)KIO3晶体是一种性能良好的非线性光学材料,晶胞如图。
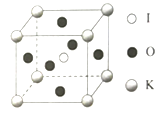
晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为________nm,与K紧邻的O的个数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,反应物中每个原子都参加氧化还原反应的是( )
A.2KNO3+3C+S![]() K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
B.2NaCl![]() 2Na+Cl2↑
2Na+Cl2↑
C.2AgNO3![]() 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:

4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是__.
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
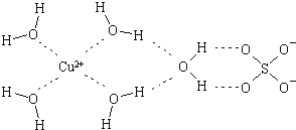
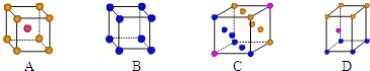
①写出基态Cu原子的核外电子排布式__;金属铜采用下列__(填字母代号)堆积方式.
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)__.
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响__.
④SO42﹣的空间构型是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于________层,配位数是________;B属于________层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。

(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式,钋位于元素周期表的第________周期第__________族,元素符号是________,最外电子层的电子排布式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol·L-1的FeCl3溶液与5 mL0.01 mol·L-1的KSCN溶液混合,建立平衡:FeCl3+3KSCN![]() 3KCl+Fe(SCN)3(红色)。
3KCl+Fe(SCN)3(红色)。
(1)若滴加饱和FeCl3溶液4滴,平衡向________方向移动,溶液红色________。
(2)若滴加1 mol·L-1KSCN溶液4滴,平衡向________方向移动,溶液红色________。
(3)若滴加0.01 mol·L-1NaOH溶液4滴,则产生____ (填颜色)沉淀,c(Fe3+)___,平衡向______方向移动,溶液红色________。
(4)若加入少量KCl固体,则平衡________移动,原因________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早在古代,我国人民就积累了不少对化学物质变化的认识。例如,晋代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这句话中的丹砂指的是HgS,下列有关说法正确的是( )
A.这个过程只涉及物理变化
B.“积变又还成丹砂”过程中发生反应:HgS![]() Hg+S
Hg+S
C.实验室中不慎洒落的水银不能用硫黄处理
D.“丹砂烧之成水银”过程中还可能产生SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用 0.1molL-1NaOH溶液滴定 20 mL 0.1 molL-1 某二元弱酸 H2A ( Ka1 =1.1×10-3,Ka2= 3.9×10-6 )溶液,滴定过程中溶液的 pH 变化曲线如图所示。下列说法正确的是
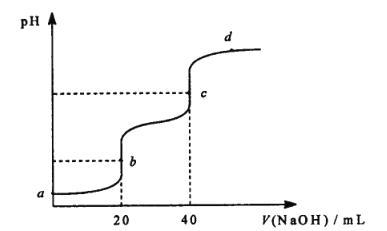
A.a 点的pH 大于2
B.b 点溶液中c(H2A) > c(A2-)
C.c 点溶液中c( HA-) + 2c(H2A ) = c( OH- )-c(H+)
D.d 点溶液中c (Na+) +c(H+) =c(A2-) +c(HA-) +c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com