
| A. | 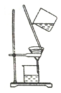 | B. | 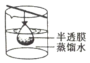 | C. |  | D. | 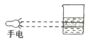 |
分析 浊液、胶体、溶液的本质区别是分散质粒子的大小不同,悬浊液的分散质粒子不能通过滤纸,浊液的分散质粒子不能透过滤纸,胶体、溶液的分散质粒子能透过滤纸;胶体和浊液的分散质粒子不能透过半透膜,溶液的分散质粒子能透过半透膜;
胶体微粒能对光线散射,产生丁达尔效应,而溶液中的离子很小,不能产生丁达尔效应;
萃取利用一种溶质在两种溶剂中的溶解度不同进行分离,与物质微粒大小无直接关系,以此来解答.
解答 解:A.悬浊液的分散质粒子不能通过滤纸,过滤利用了分散质粒子的大小进行分离,故A不选;
B.胶体的分散质粒子不能透过半透膜,溶液的分散质粒子能透过半透膜,渗析利用了分散质粒子的大小进行分离,故B不选;
C.萃取利用一种溶质在两种溶剂中的溶解度不同进行分离,与物质微粒大小无直接关系,故C选;
D.胶体微粒能对光线散射,产生丁达尔效应,而溶液中的离子很小,不能产生丁达尔效应,丁达尔效应与分散质粒子的大小有关,故D不选;
故选C.
点评 本题考查胶体的性质,为高频考点,题目难度不大,把握分散系的根本区别为解答的关键,注意掌握胶体的性质,试题侧重分析与应用能力的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应不是氧化还原反应 | B. | 氮气只是氧化产物 | ||
| C. | N2O4是还原剂 | D. | N2O4是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④ | C. | ②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于置换反应 | B. | 碳发生了还原反应 | ||
| C. | 二氧化硅是氧化剂 | D. | 24g碳充分反应生成28g硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO 中氯元素化合价比 HClO4 中氯元素化合价低,所以 HClO4 的氧化性强 | |
| B. | 已知①Fe+Cu2+═Fe2++Cu; ②2Fe3++Cu═2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+ | |
| C. | 已知还原性 B->C->D-,反应 2C-+D2═2D-+C2 和 2C-+B2=2B-+C2 都能发生 | |
| D. | 具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com