
下列指定溶液中一定能大量共存的离子组是( )
A.pH=1的溶液中:NH 、Na+、Fe3+、SO
、Na+、Fe3+、SO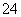
B.含有大量AlO 的溶液中:Na+、K+、HCO
的溶液中:Na+、K+、HCO 、NO
、NO
C.中性溶液中:K+、Al3+、Cl-、SO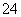
D.Na2S溶液中:SO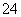 、K+、Cu2+、Cl-
、K+、Cu2+、Cl-
 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
下列有关σ键和π键的说法错误的是( )
A.含有π键的分子在反应时,π键是化学反应的积极参与者
B.当原子形成分子时,首先形成σ键,可能形成π键
C.有些原子在与其他原子形成分子时,只能形成σ键,不能形成π键
D.在分子中,化学键可能只有π键而没有σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度、相同浓度下的八种溶液,其pH由小到大的顺序如图所示,图中①②③④⑤代表的物质可能分别为( )
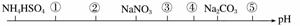
A.NH4Cl (NH4)2SO4 CH3COONa NaHCO3 NaOH
B.(NH4)2SO4 NH4Cl CH3COONa NaHCO3 NaOH
C.(NH4)2SO4 NH4Cl NaOH CH3COONa NaHCO3
D.CH3COOH NH4Cl (NH4)2SO4 NaHCO3 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,H2SO3??HSO +H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=______mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=______mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中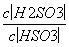 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列关于电解质溶液的判断正确的是( )
A.在pH=12的溶液中,K+、Cl-、HCO 、Na+可以大量共存
、Na+可以大量共存
B.在pH=0的溶液中,Na+、NO 、SO
、SO 、K+可以大量共存
、K+可以大量共存
C.由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液中存在BOH===B++OH-
D.由0.1 mol·L-1一元酸HA溶液的pH=3,可推知NaA溶液中存在A-+H2O??HA+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
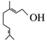 ,下列有关香叶醇的叙述正确的是( )
,下列有关香叶醇的叙述正确的是( )
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应不能发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com