
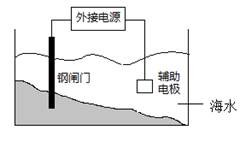
| A.钢闸门应与外接电源的负极相连 |
| B.该装置的原理是“牺牲阳极阴极保护法” |
| C.辅助电极材料可用锌 |
| D.阴极的电极反应式:2Cl--2e→Cl2↑ |
科目:高中化学 来源:不详 题型:单选题
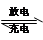 2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
| A.放电时,H2SO4浓度降低 |
| B.充电时,电源正极与蓄电池的“—”极连接 |
| C.负极的电极反应式为:Pb+SO42--2e-=PbSO4 |
| D.因PbSO4难溶,铅蓄电池报废后无需回收处理 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 R2Cu+2H+。则萃取和反萃取进行的程度受 和 的影响。
R2Cu+2H+。则萃取和反萃取进行的程度受 和 的影响。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在101kpa下,1mol物质完全燃烧的反应热叫做该物质的热值 |
| B.盐桥通常用含CuCl2的饱和溶液的琼脂的离子移动来平衡溶液中的电荷 |
| C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH |
| D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
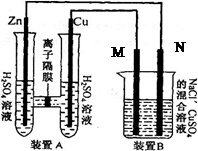
 混合溶液,溶液体积为500mL,M、N均为石墨电极,当装置A中Zn棒质量减少32.5g时,N上质量增加____________g;
混合溶液,溶液体积为500mL,M、N均为石墨电极,当装置A中Zn棒质量减少32.5g时,N上质量增加____________g;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

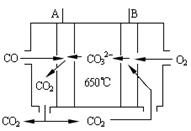
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
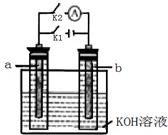
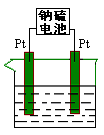
| A.t1时刻开始断开K2,闭合K1一段时间,溶液的pH要变大 |
| B.t2时刻断开K1,闭合K2时,b极上的电极反应式为:2H++2e—= H2↑ |
| C.t1时刻断开K2,闭合K1时,a极上的电极反应式为:4OH—―4e—=O2↑ +2H2O |
| D.t2时刻断开K1,闭合K2时,OH-向b极移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 钢铁生锈过程发生如下反应:
钢铁生锈过程发生如下反应: ①2Fe+O2+2H2O=2Fe(OH)2;
①2Fe+O2+2H2O=2Fe(OH)2;
 ③2Fe(OH)3=Fe2O3+3H2O。
③2Fe(OH)3=Fe2O3+3H2O。 下列说法正确的是
下列说法正确的是 A.反应①、②中电子转移数目相等
A.反应①、②中电子转移数目相等

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com