
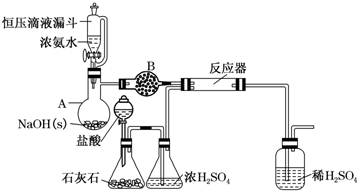
分析 浓氨水在氢氧化钠作用下生成氨气,氨气在B中可用碱石灰干燥,浓盐酸和石灰石反应生成二氧化碳,用浓硫酸干燥,在反应器中,一定条件下反应生成H2N-COONH4,稀硫酸用于吸收氨气,防止污染环境.
(1)依据图形和作用分析仪器B为干燥管(球形干燥管),由连接的A制备氨气可知,干燥管B中盛装的是碱石灰;
(2)石灰石与盐酸反应生成二氧化碳和水;
(3)对比氨基甲酸铵的结构简式与尿素的结构简式可写出反应方程式;
(4)反应在一定条件下能自发进行,则△G=△H-T△S<0,由于△S<0,所以△H必须小于0;
(5)使用干冰代替CO2发生装置的优点有很多,如省去了复杂仪器的连接,使得装置较为简单,易于操作;由(3)可知合成氨基甲酸铵的反应为放热反应,故干冰创造的低温环境有利于氨基甲酸铵的生成;不用对干冰进行干燥处理;
(6)导管过细有可能导致堵塞现象发生;用盐酸制备的二氧化碳气体中混有的HCl消耗氨气;稀硫酸、水蒸气进入反应器使产品不纯等.
解答 解:(1)仪器B为干燥管(球形干燥管),由连接的A制备氨气可知,干燥管B中盛装的是碱石灰,用来干燥氨气,
故答案为:干燥管;碱石灰;
(2)石灰石与盐酸反应生成二氧化碳和水,反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(3)对比氨基甲酸铵的结构简式与尿素的结构简式,依据原子守恒得到氨基甲酸铵在密封管内加热至120℃-140℃生成尿素的反应方程式为:NH2COONH4$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2+H2O,
故答案为:NH2COONH4$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2+H2O;
(4)反应在一定条件下能自发进行,则△G=△H-T△S<0,由于△S<0,所以△H必须小于0,△H<0,
故答案为:<;
(5)干冰代替CO2发生装置的优点有很多,如省去了复杂仪器的连接,使得装置较为简单,易于操作,无需干燥,装置简单;由(3)可知合成氨基甲酸铵的反应为放热反应,故干冰创造的低温环境有利于氨基甲酸铵的生成,不用对干冰进行干燥处理,低温环境提高产率,
故答案为:无需干燥装置简单,低温环境提高产率;
(6)从实验装置可以看出导管过细,有可能导致堵塞现象发生;用盐酸制备的二氧化碳气体中混有的HCl消耗氨气;稀硫酸、水蒸气进入反应器使产品不纯等,
故答案为:反应器连接导管过细易造成堵塞;水蒸气可进入反应器使产品不纯;CO2发生器中挥发出的HCl未经处理进入反应器,会导致实验失败.
点评 本题考查物质的制备,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的原理和操作方法,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA | |
| B. | 常温常压下,1.06 g Na2CO3含有的Na+个数为0.02NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 含有NA个氧原子的氧气在标准状况下的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| a、b可能的关系 | 生成的沉淀的质量/g |
| b≤3a | 2.6b |
| b≥4a | 0 |
| 3a<b<4a | 31.2a-7.8b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
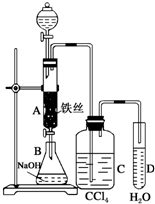 某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉定时 | 8.3 | 7.6 | 2.7 | 6.7 |
| 完全沉淀时 | 9.8 | 9.6 | 3.7 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com