
| A. | 盐溶于水 | B. | 酒精挥发 | C. | 水结成冰 | D. | 铁器生锈 |
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
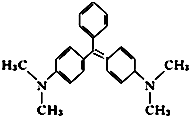 孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸. 其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )
孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸. 其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )| A. | 孔雀石绿的分子式为C23H25N2 | |
| B. | 孔雀石绿属于芳香烃 | |
| C. | 孔雀石绿苯环上的一氯取代物有5种 | |
| D. | 1mol孔雀石绿在一定条件下最多可与6 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的电子排布图为
.若元素X的原子最外层电子排布式为nsn-1npn+1,那么X的元素符号为S,原子的电子排布图为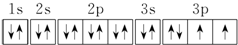 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | C、N、O原子半径依次减小 | D. | P、S、Cl最高正价依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Ⅰ对于4FeS2+11O2═2Fe2O3+8SO2,试回答有关的问题:
Ⅰ对于4FeS2+11O2═2Fe2O3+8SO2,试回答有关的问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 | B. | 0.10 | C. | 0.15 | D. | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g•cm-3 | |
| B. | 此溶液中KCl的质量分数为$\frac{74.5}{1.174×1000}$×100% | |
| C. | 密度大于1.174 g•cm-3的KCl溶液是过饱和溶液 | |
| D. | 25℃时,饱和KCl溶液的浓度大于4.0 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验题
实验题| 实验步骤 | 实验现象 |
| I.向编号为①②③的3支试管中,分别加入1mL 20%的蔗糖溶液,向试管②和③中加入0.5mL稀硫酸,并将这3支试管同时水浴加热约5min | 均无明显现象 |
| II.取试管①和②,加入新制氢氧化铜悬浊液,加热至沸腾 | 未见砖红色沉淀 |
| Ⅲ.取试管③,先加入NaOH溶液(或其它碱性溶液)调溶液pH至碱性,再加入新制氢氧化铜悬浊液,加热至沸腾 | 试管③中观察到产生砖红色沉淀 |
| 结论:证明蔗糖在稀硫酸作用下发生了水解反应. | |
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com