
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | |
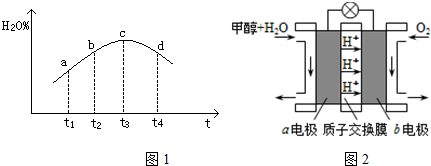
分析 (1)根据方程式3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H=-1591.2kJ/mol,可知每转移12mol电子,放出1591.2kJ热量,据此计算;
(2)①根据v=$\frac{△c}{△t}$计算v(H2),再根据速率之比等于化学计量数之比计算v(CO2);
②利用化学平衡三段式及化学平衡常数的表达式计算;
③a.容器内CO、H2O、CO2、H2的浓度不再变化,则说明反应处于平衡状态;
b.恒温、恒容条件下,气体的总物质的量始终不变,压强始终不变;
c.恒容条件下,反应物和产物都是气体,密度始终不变;
d.υ正(CO)=υ逆(CO2),转化成CO2的正、逆反应速率相等;
e.该反应气体的物质的量不变,气体的质量也不变,所以反应过程中气体的平均相对分子质量不变;
④c到达平衡,而b点未达到平衡,正反应速率减小,逆反应速率增大至相等;该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行;
(3)负极失去电子发生氧化反应,正极得到电子发生还原反应;根据电子守恒求消耗的氢氧根离子浓度.
解答 解:(1)根据方程式3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)△H=-1591.2kJ/mol,可知每转移12mol电子,放出1591.2kJ热量,所以每转移1mole-可放出的热量为:$\frac{1591.2kJ}{12}$=132.6kJ,
故答案为:132.6kJ;
(2)①实验Ⅰ中,前5min的反应速率v(H2)=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15mol•L-1•min-1,速率之比等于化学计量数之比,则v(CO2)=v(H2)=0.15mol•L-1•min-1,
故答案为:0.15mol•L-1•min-1;
②CO(g)+H2O(g)?CO2(g)+H2(g),
初始(mol/L)0.5 1 0 0
转化(mol/L)0.25 0.25 0.25 0.25
平衡(mol/L)0.25 0.75 0.25 0.25
则900℃时该反应的平衡常数K=$\frac{0.25×0.25}{0.25×0.75}$=$\frac{1}{3}$,
故答案为:$\frac{1}{3}$;
③a.容器内CO、H2O、CO2、H2的浓度不再变化,则说明反应处于平衡状态,故a正确;
b.恒温、恒容条件下,气体的总物质的量始终不变,压强始终不变,故b错误;
c.恒容条件下,反应物和产物都是气体,密度始终不变,故c错误;
d.υ正(CO)=υ逆(CO2),转化成CO2的正、逆反应速率相等,说明反应处于平衡状态,故d正确;
e.该反应气体的物质的量不变,气体的质量也不变,所以反应过程中气体的平均相对分子质量不变,所以不能说明反应是否处于平衡状态,故e错误,
故答案为:ad;
④c到达平衡,而b点未达到平衡,正反应速率减小,逆反应速率增大至相等,故b点υ正>υ逆;
该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行,故t3~t4时刻,H2O(g)的转化率降低,
故答案为:>;该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行;
(3)负极发生氧化反应,负极电极反应式为:CH3OH-6e-+H2O=CO2+6H+,正极氧气得到电子生成氢氧根离子,正极反应式为:O2+4e-+4H+=2H2O;
依据电子守4OH-~O2~4e-,当消耗560mLO2(标准状况下)时即$\frac{0.56L}{22.4L/mol}$=0.025mol,依据电子守恒4OH-~O2~4e-,则消耗的氢氧根离子物质的量为0.025mol×4=0.1mol,所以溶液中氢离子的浓度为:$\frac{0.1}{1}$=0.1mol/L,则电解后溶液的pH=1,
故答案为:O2+4e-+4H+=2H2O;1.
点评 本题考查较为综合,涉及化学平衡常数、化学反应速率的计算、化学平衡状态的判断、原电池工作原理及应用、反应热计算等知识,题目难度中等,注意掌握化学平衡常数、化学反应速率的概念及表达式,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
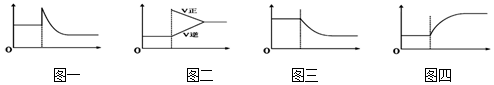
| A. | 可逆反应:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硫酸,溶液变橙色,氢离子浓度随时间变化曲线如图一 | |
| B. | 可逆反应Co(H2O)62+(粉红色)+4Cl-?CoCl42- (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如图二 | |
| C. | 可逆反应:2NO2?N2O4达平衡状态呈红棕色,加压红棕色变深,NO2物质的量随时间变化曲线如图三 | |
| D. | 可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如图四 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{20}^{40}$Ca和${\;}_{18}^{40}$Ar | B. | 16O和18O | ||
| C. | H2O和H2O2 | D. | O3和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、HBr、HI、HF的沸点依次升高 | |
| B. | 氨分子中N-H键的极性小于水分子中O-H键的极性 | |
| C. | 乙醇分子间存在氢键,乙醛分子间不存在氢键,故乙醇的沸点高于乙醛 | |
| D. | 由于N-H键强于P-H键,故NH3的沸点高于PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化镁和稀盐酸反应 | B. | Ba(OH)2溶液滴入稀硫酸中 | ||
| C. | 澄清石灰水和稀硝酸反应 | D. | CH3COOH溶液和NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无法比较 | B. | Q1<Q2 | C. | Q1=Q2 | D. | Q1>Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com