
分析 (1)卤代烃在碱的醇溶液中加热发生消去反应生成烯烃;
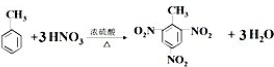
(2)甲苯和硝酸发生取代反应生成TNT;
(3)1,2-二氯乙烷与NaOH的水溶液共热,发生水解反应生成乙二醇.
解答 解:(1)(2)2-氯丙烷与KOH的乙醇溶液供热发生消去反应,方程式为:CH3-CHCl-CH3+NaOH$→_{△}^{乙醇}$CH3-CH=CH2+NaCl+H2O,
故答案为:CH3-CHCl-CH3+NaOH$→_{△}^{乙醇}$CH3-CH=CH2+NaCl+H2O;
(2)甲苯可以和浓硝酸之间发生取代反应生成2,4,6-三硝基甲苯,即TNT,化学反应方程式为 ,
,
故答案为: ;
;
(3)卤代烃在氢氧化钠的水溶液中发生水解反应生成醇类,所以1,2-二氯乙烷与氢氧化钠水溶液共热可以生成乙二醇(HOCH2CH2OH)的反应方程式为:
ClCH2CH2Cl+2NaOH$\stackrel{加热}{→}$HOCH2CH2OH+2NaCl,
故答案为:ClCH2CH2Cl+2NaOH$\stackrel{加热}{→}$HOCH2CH2OH+2NaCl.
点评 本题考查了方程式的书写,侧重考查有机反应方程式的书写,熟悉有机物的结构是解题关键,注意反应条件,题目难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 聚乙烯、聚乙炔都不能使酸性高锰酸钾褪色 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| D. | 光照下2,2-二甲基丙烷与Br2反应,其中一溴取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,向一定体积0.1mol/LNaOH溶液中逐滴加入等浓度的CH3COOH溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则下列说法错误的是( )
某温度下,向一定体积0.1mol/LNaOH溶液中逐滴加入等浓度的CH3COOH溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则下列说法错误的是( )| A. | Q点消耗CH3COOH溶液的体积等于NaOH溶液的体积 | |
| B. | M、Q、N三点都满足:C(Na+)+C(H+)═c(CH3COO-)+C(OH-) | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | N点所示溶液中c(CH3COO-)<c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | v(A)=9 mol/(L•min) | B. | v(B)=18 mol/(L•min) | ||
| C. | v(A)=4.5 mol/(L•min) | D. | v(B)=4.5 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组的同学欲测定该补血剂中铁元素的含量.实验步骤如图:
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组的同学欲测定该补血剂中铁元素的含量.实验步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| B. | 光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 垃圾是放错地方的资源,应分类回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M分子式为C6H6O7 | |
| B. | 1 mol物质M可以和3 mol氢气发生加成 | |
| C. | M分子不可以发生消除反应 | |
| D. | 足量的M分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com