
| 时间 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
分析 (1)①反应方程式为CH4(g)+H2O(g)=CO(g)+3H2(g)根据三行式代入平衡常数表达式进行计算;
②根据表中数据可知3min时达到平衡,再根据4min时各组分浓度变化量判断改变的条件;
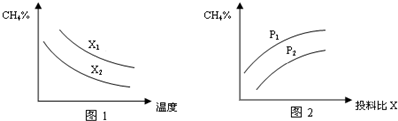
(2)①碳水比n(CH4)/n(H2O)值越大,平衡时甲烷的转化率越低,含量越高;
②根据压强对平衡移动影响,结合图象分析解答;
(3)①甲烷燃料电池工作时,负极发生氧化反应,甲烷失电子被氧化反应;
②计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据n(KOH)与n(CO2)比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断离子浓度大小.
解答 解:(1)①反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g),
初起量(mol•L-1):0.2 0.3 0 0
变化量(mol•L-1):0.1 0.1 0.1 0.3
平衡量(mol•L-1):0.1 0.2 0.1 0.3
所以K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$=$\frac{0.1×0.{3}^{3}}{0.1×0.2}$,故答案为:$\frac{0.1×0.{3}^{3}}{0.1×0.2}$;
②3min时改变的反应条件,反应向正反应方向进行,可能为升高温度或增大H2O的浓度或减小CO的浓度,故答案为:升高温度或增大H2O的浓度或减小CO的浓度;
(2)①碳水比n(CH4)/n(H2O)值越大,平衡时甲烷的转化率越低,含量越高,故x1>x2,故答案为:>;
②该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量增大,故p1>p2,故答案为:>;
(3)①甲烷燃料电池工作时,负极发生氧化反应,甲烷失电子被氧化反应,负极电极反应式为CH4-8e-+10OH-=CO32-+7H2O,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
②KHCO3溶液中碳酸氢根离子的水解程度大于其电离程度,所以溶液显示碱性,则该溶液中各离子浓度由大到小的关系为,故c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),
故答案为:c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
点评 本题综合性较大,涉及化学平衡图象、化学平衡的影响因素、化学平衡计算、原电池、化学计算、离子浓度比较等,为高考常见题型,难度中等,是对基础知识与学生能力的综合考查,注意把握化学平衡的影响因素以及图象、数据的分析能力的培养.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0 | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H<0 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H<0 | |
| D. | 3Cu(s)+8HNO3(aq)═3Cu(NO3)2(aq)+2NO(g)+4H2O(l)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Al3+、Cl-、NO3- | B. | Al3+、Mg2+、SO42-、OH- | ||
| C. | Fe2+、H+、K+、MnO4- | D. | Cu2+、H+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
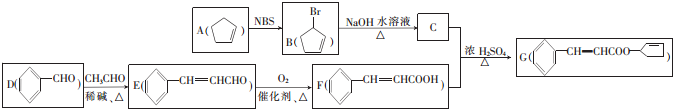
 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr,其反应类型为取代反应.
+NaBr,其反应类型为取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com