
| A. | 离子晶体中一定含有离子键 | |
| B. | 分子晶体中一定含有共价键 | |
| C. | 氧化钠和过氧化钠中含有的化学键种类相同 | |
| D. | 通常情况下水分子较稳定,是因为水分子间存在氢键 |
分析 A.含有离子键的晶体是离子晶体,离子晶体中可能含有共价键;
B.分子晶体中可能只含分子间作用力而不存在化学键;
C.过氧化钠中含有离子键和非极性键,氧化钠中只存在离子键;
D.物质的稳定性与化学键有关,与分子间作用力无关.
解答 解:A.含有离子键的晶体是离子晶体,所以离子晶体中一定含有离子键,离子晶体中可能含有共价键,如KOH,故A正确;
B.分子晶体中可能只含分子间作用力而不存在化学键,如稀有气体,故B错误;
C.过氧化钠中含有离子键和非极性键,氧化钠中只存在离子键,所以二者含有化学键类型不同,故C错误;
D.物质的稳定性与化学键有关,与分子间作用力无关,所以水分子稳定性与氢键无关,氢键影响其熔沸点,故D错误;
故选A.
点评 本题考查化学键判断,侧重考查基本概念,明确物质构成微粒及微粒之间作用力即可解答,采用举例法分析解答,注意规律中的异常现象,易错选项是BD.


科目:高中化学 来源: 题型:填空题
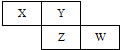 X、Y、Z、W四种短周期元素在周期表中的位置关系如图
X、Y、Z、W四种短周期元素在周期表中的位置关系如图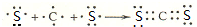 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
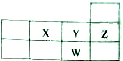
| A. | 原子半径大小:W>Y>X | B. | 核电荷数:W>Z>Y>X | ||
| C. | W的氧化物对应的水化物为强酸 | D. | X是ⅥA族元素,其最高化合价为+6价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
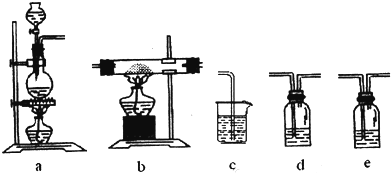
| A. | 装置a烧瓶内加入的固体可以是MnO2 | |
| B. | 若按a、e、d、b、c顺序连接装置,则e中盛装的是浓硫酸 | |
| C. | 制备过程中装置b硬质玻璃管内有红棕色的烟产生 | |
| D. | 验证产物中的Fe3+存在可使用KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数为2的元素一定处于周期表ⅡA族 | |
| B. | 主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5 | |
| C. | 氯化氢的沸点比溴化氢的沸点高 | |
| D. | Li、Na、K单质的熔点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
体积分数/% 压强/MPa 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1 000 | e | f | 83.0 |
| A. | a<54.0 | B. | b>f | ||
| C. | 915℃,2.0 MPa时E的转化率为60% | D. | K(1000℃)>K(810℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ NO3- SO42- | B. | Ag+ NO3- Cl- | ||
| C. | K+ H+ HCO3- | D. | NH4+ Na+ OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeBr2溶液与Cl2 | B. | Ca(HCO3)2溶液与KOH溶液 | ||
| C. | NaHCO3溶液与Al2(SO4)3溶液 | D. | NaHSO4溶液与Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸 | B. | 乙醇 | ||
| C. | 乙醛 | D. | 甲醇和丙三醇的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com