解答:
解:(1)①CH
4(g)+
O
2(g)=CO(g)+2H
2(g)△H
1=-35.6kJ?mol
-1②CH
4(g)+2O
2(g)═CO
2(g)+2H
2O(g)△H
2=-890.3kJ?mol
-1③CH
4(g)+CO
2(g)═2CO(g)+2H
2(g)△H
3=247.3kJ?mol
-1结合盖斯定律计算,①×2-②×
-③可知反应CH
4(g)+H
2O (g)=CO (g)+3H
2(g)△H=①×2-②×
-③×=250.3kJ?mol
-1;
故答案为:CH
4(g)+H
2O(g)=CO(g)+3H
2(g)△H=250.3kJ?mol
-1;
(2)根据反应N
2 +3H
2 ?2NH
3初始浓度:0.5 1.3 0
变化浓度:0.1 0.3 0.2
平衡浓度:0.4 1.0 0.2
所以达到平衡时平衡常数K=
=0.1mol/L,前20min的平均速率v(H
2)=
v(NH
3)=
×
=0.015mol/L?min;
N
2 +3H
2 ?2NH
3 ,反应是气体体积减小的放热反应,平衡正向进行能提高反应中N
2的平衡转化率;
A.两种反应物中增加一种会提高另一种的转化率,本身转化率减小,增加N
2的浓度,氮气转化率减小,故A错误;
B.增加H
2的量会提高氮气的转化率,故B正确;
C.移出部分NH
3 ,减小生成物浓度,平衡正向进行,氮气转化率增大,故C正确;
D.反应是放热反应,提高反应温度,平衡逆向进行,氮气转化率减小,故D错误;
E.减小容器的容积,增大压强,平衡正向进行,氮气转化率增大,故E正确;
F.加入合适的催化剂改变反应速率,步步改变化学平衡,氮气转化率不变,故F错误;
故答案为:0.1mol/L;0.015mol/L?min;BCE;
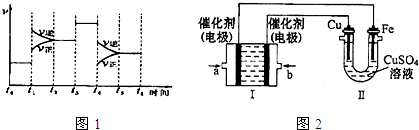
(3)分析图象变化,若t
1时改变的条件是升高温度,平衡逆向进行,正反应是放热反应;t
3时刻改变的条件是加入催化剂,改变反应速率不改变化学平衡;t
4时刻正逆反应速率减小,平衡逆向进行,应是增大体积减小压强;平衡常数随温度变化,不随浓度、压强变化,依据条件改变和平衡移动方向分析,NH
3的体积分数最小的一段时间为 t
5→t
6,化学平衡常数随温度变化,不随浓度,压强变化,所以最大的一段时间t
0→t
1;上述分析可知t
4改变的条件是 减小压强;
故答案为:D;A;减小压强;
(4)图Ⅰ为原电池,为甲烷燃烧电池,燃料甲烷做原电池负极反应物失电子发生氧化反应,图Ⅱ为电解池,铁棒镀铜,推断铁做电解池阴极,铜做电解池阳极;a为原电池负极,b为原电池正极;
①b处是氧气得到电子发生的电极反应;电极反应为:O
2+2H
2O+4e
-=4OH
-,故答案为:O
2+2H
2O+4e
-=4OH
-;
②原电池反应是碱性溶液中进行消耗氢氧根生成水,溶液PH减小;装置Ⅱ是电镀阳极电极反应可知,阳极电极反应为:Cu-2e
-=Cu
2+,阴极电极反应为:Cu
2++2e
-=Cu,铜离子浓度不变,故答案为:变小;不变;
③装置Ⅱ中阴极电极反应为Cu
2++2e
-=Cu,质量增加12.8g为铜物质的量为0.2mol,转移电子为0.4mol,装置I中负极电极反应为:CH
4+10OH
--8e
-=CO
32-+7H
2O理论上消耗氧气物质的量为:0,1mol,标准状况下的体积=0.1mol×22.4L/mol=2.24L,故答案为:2.24.



 科学实验活动册系列答案
科学实验活动册系列答案