
| A. | CaO 与CO2 | B. | NaCl与HCI | C. | SiC 与SiO2 | D. | CCl4与I2 |
分析 物质的熔点均与所含化学键的键能有关,则对应的晶体一般为金属晶体、离子晶体或原子晶体,而分子晶体熔化时只克服分子间作用力,以此解答该题.
解答 解:A.CaO为离子化合物,熔化断裂离子键,而CO2在固体时是分子晶体,熔化时破坏的是分子间作用力,与化学键无关,故A错误;
B.NaCl为离子化合物,熔化断裂离子键,而HCl在固体时是分子晶体,熔化时破坏的是分子间作用力,与化学键无关,故B错误;
C.SiC与SiO2都是原子晶体,熔化断裂的是共价键,与化学键有关,故C正确;
D.CCl4与I2在固体时是分子晶体,熔化时破坏的是分子间作用力,与化学键无关,故D错误.
故选C.
点评 本题考查物质中的化学键,为高频考点,把握化学键的形成及化学键判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 所得气体在标准状况下的体积 | B. | 所得气体的质量 | ||
| C. | 所得溶液的浓度 | D. | 原硫酸的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
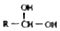 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$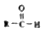 请根据如图回答:
请根据如图回答: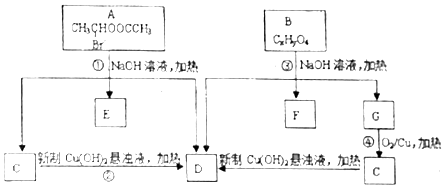
 .
. ;②CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O+3H2O.
;②CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O+3H2O.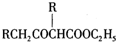 +C2H3OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).
+C2H3OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:A13++4NH3•H2O═4NH4++2H2O+A1O2- | |
| B. | FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2C12═2Fe3++Br2+4C1- | |
| C. | 硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2═Fe3++2H2O | |
| D. | 在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3-+Br2+H2O═3H++2Br-+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体可用于净水 | |
| B. | 镁合金可用于制造导弹、飞机的部件 | |
| C. | 石灰石-石膏法可用于燃煤的脱硫 | |
| D. | 焦炭在炼铁高炉中用于直接还原铁矿石 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、O2和Cl2分子中既含有σ键,又含有π键 | |
| B. | PCl3分子中,中心原子采取SP3杂化方式 | |
| C. | CS2、H2O、C2H2都是直线型分子 | |
| D. | CH4、CCl4、C6H6都是只含有极性键的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | Al2(SO4)3═Al3++SO42- | D. | NH3•H2O═NH4++OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com