
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:X | D和E 1:3 | B和E 1:4 |
 ;
;分析 原子序数依次增大的A、B、C、D、E五种短周期主族元素,B原子最外层电子数比其次外层电子数多2个,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,二者不可能同周期,A的原子序数小于碳,只能处于第一周期,可推知A为H元素;D和E的原子序数之和为30,二者只能处于第三周期,为Al与Cl或Si与S,且D、E形成的化合物丙中D:E=1:3,则D为Al、E为Cl;C是E的邻族元素,C的原子序数小于铝,则C为氧元素,可推知甲为H2O2,丙为AlCl3,丁为CCl4,若有机物乙的分子为平面结构,碳氢键键角为120°,当X=2时,乙为C2H4,当X=1时,乙为苯.
解答 解:原子序数依次增大的A、B、C、D、E五种短周期主族元素,B原子最外层电子数比其次外层电子数多2个,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,二者不可能同周期,A的原子序数小于碳,只能处于第一周期,可推知A为H元素;D和E的原子序数之和为30,二者只能处于第三周期,为Al与Cl或Si与S,且D、E形成的化合物丙中D:E=1:3,则D为Al、E为Cl;C是E的邻族元素,C的原子序数小于铝,则C为氧元素,可推知甲为H2O2,乙为C2H4,丙为AlCl3,丁为CCl4.
(1)化合物甲为H2O2,电子式为 ,故答案为:
,故答案为: ;
;
(2)若有机物乙的分子为平面结构,碳氢键键角为120°,当X=2时,乙为C2H4,结构简式为CH2=CH2,当X=1时,乙为苯,乙的二氯代物结构有邻、间、对3种,故答案为:CH2=CH2;3.
点评 本题考查元素化合物推断,充分利用短周期元素、核外电子排布特点、化合物中原子数目之比进行推断,难度中等.


科目:高中化学 来源: 题型:选择题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为0.8 mol/L | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.009 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中溶质的质量分数 | B. | 溶液中阳离子数目 | ||
| C. | 溶液的质量 | D. | 浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:4 | B. | 4:5 | C. | 5:12 | D. | 12:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
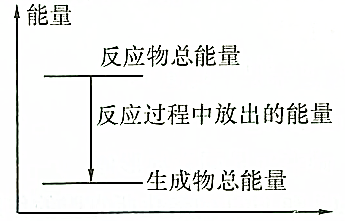
| A. | 反应过程中的能量关系可用如图表示 | |
| B. | 1mol锌所含的能量高于1mol H2 所含的能量 | |
| C. | 若将其设计为原电池,则锌为正极 | |
| D. | 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳气体通入氨水中 | B. | 二氧化硫气体通入澄清石灰水中 | ||
| C. | 五氧化二磷投入碱溶液中 | D. | 二氧化硅投入烧碱溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将机动车尾气排放标准从国家Ⅱ号标准提高到国家Ⅲ号标准 | |
| B. | 采用强氧化剂将SO2氧化为SO3再排放到大气中 | |
| C. | 采用原煤脱硫技术,降低燃煤中硫的含量 | |
| D. | 向燃煤中加入适量石灰石,减少燃烧产物中SO2的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com