
分析 (1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,据此判断a、b大小关系;
(2)根据反应的热效应判断化学平衡常数的变化;
(3)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质物质的量、物质的量浓度、百分含量都不变,以及由此引起的一系列物理量不变;
(4)该反应是一个反应前后气体体积减小的放热反应,为使该反应的反应速率增大,且平衡向正反应方向移动,应该采用增大反应物浓度方法;
解答 解:(1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,而加入2mol A2和1mol B2达到平衡时,没有完全反应,即释放的热量小于完全反应释放的热量,即b<a,
故答案为:>;
(2)正反应方向放热,升高温度,化学平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,K减小,
故答案为:减小;
(3)a、V(C3)=2V(B2)时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应初始浓度及转化率有关,不能据此判断平衡状态,故错误;
b、该反应是一个反应前后气体体积减小的可逆反应,当容器内压强保持不变时,正逆反应速率相等,反应达到平衡状态,故正确;
c、V逆(A2)=2V正(B2)=V正(A2),同一物质的正逆反应速率相等,该反应达到平衡状态,故正确;
d、混合气体遵循质量守恒定律,则反应前后混合气体质量不变,容器体积不变,则容器内的密度保持不变,不能据此判断平衡状态,故错误;
故选bc;
(4)a、及时分离出C3气体,平衡正向移动,但反应速率减小,故错误;
b、适当升高温度反应速率增大但平衡逆向移动,故错误;
c、增大B2的浓度,平衡正向移动且反应速率增大,故正确;
d、选择高效的催化剂,反应速率增大但平衡不移动,故错误;
故选c.
点评 本题考查化学平衡影响因素、化学反应速率影响因素、平衡状态判断等知识点,为高频考点,注意:催化剂只影响反应速率不影响平衡移动,只有反应前后改变的物理量不变时可逆反应才能达到平衡状态,为易错点.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
 某蓄电池的反应为NiO2+Fe+2H2O$?_{放电}^{充电}$Fe(OH)2+Ni(OH)2.
某蓄电池的反应为NiO2+Fe+2H2O$?_{放电}^{充电}$Fe(OH)2+Ni(OH)2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
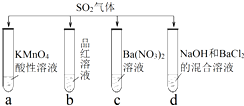
| A. | 试管a中实验可以证明具有漂白性 | |
| B. | 试管b中溶液褪色,说明具有强氧化性 | |
| C. | 试管c中能产生白色沉淀,说明具有还原性 | |
| D. | 试管d中能产生白色沉淀,该沉淀完全溶于 稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O;已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
;反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O;已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
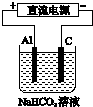
| A. | 用Al作电极电解NaHCO3溶液:2Al+6H2O═2Al(OH)3↓+3H2↑ | |
| B. | 向明矾溶液中加入氢氧化钡溶液至沉淀质量最大时:2Al3++2SO42-+2Ba2++6OH-═2BaSO4↓+2Al(OH)3↓ | |
| C. | 碳酸钠的水解反应:CO32-+H3O+═HCO3-+H2O | |
| D. | 酸性高锰酸钾溶液与双氧水反应:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O和18O原子的核外电子排布不相同 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | HF、HCl、HBr、HI的熔沸点逐渐升高 | |
| D. | 干冰和二氧化硅熔化时所克服微粒间的相互作用相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
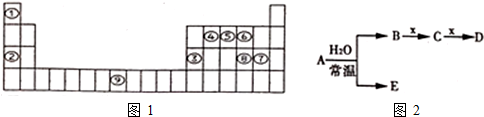
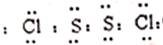 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com