
为提纯下列物质(括号内的物质是杂质),所选用的除杂 试剂和分离方法都正确的是( )
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 溴化钠溶液(NaI) | 氯水、CCl4 | 萃取、分液 |
| B | 氯化铵溶液(FeCl3) | 氢氧化钠溶液 | 过滤 |
| C | 二氧化碳(CO) | 氧化铜粉末 | 通过灼热的CuO粉末 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
已知0.1 mol·L-1的二元酸H2A溶液的pH=4,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有[Na+]+[H+]=[HA-]+[OH-]+2[A2-]
D.在Na2A溶液中一定有[Na+]>[A2-]>[H+]>[OH-]
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,体积为2 L的密闭容器中A、B、C三种气体的起始浓度和平衡浓度如下表:
| 物质 | A | B | C |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法中正确的是( )
A.发生的反应可表示为A+B2C
B.反应达到平衡时B的转化率为25%
C.若起始时密闭容器中有0.1 mol A、0.1 mol B、0.2 mol C时,反应达平衡时,c(A)=0.05 mol·L-1
D.改变起始时容器中各气体的物质的量,可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列 化学反应在理论上可以设计成原电池的是___________。
化学反应在理论上可以设计成原电池的是___________。
A.C(s)+H2O(g)====CO(g)+H2(g) ΔH>0
B.NaOH( aq)+HCl(aq)====NaCl(aq)+H2O(l) ΔH<0
aq)+HCl(aq)====NaCl(aq)+H2O(l) ΔH<0
C.2H2(g)+O2(g)====2H2O(l) ΔH<0
(2)以KOH溶液为电解质溶液,依据你所选反应,设计一个原电池,其负极反应为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某同学鉴别NH4HCO3、NH4Cl、KCl三种化肥的过程,其中试剂甲和乙分别可能是( )
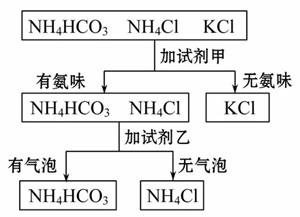
A.甲:熟石灰;乙:稀盐酸
B.甲:水;乙:氢氧化钠溶液
C.甲:氯化钠溶液;乙:稀硫酸
D.甲:稀盐酸;乙:氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是 ( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
| C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.100 0 mol·L-1盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,正确的是( )
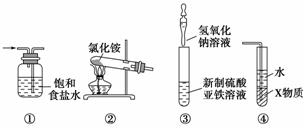
A.装置①是洗气装置,除去氯气中的氯化氢
B.实验室用装置②制取氨气
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④中X若为四氯化碳,可用于吸收氨气,并防止倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述不正确的是( )
A.天然气和沼气的主要成分是甲烷
B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
C.纤维素乙酸酯、油脂和蛋白质在一定条件下都能水解
D.葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,AgCl的Ksp=1.8×10-10 mol2·L-2,AgBr的Ksp=4.9×
10-13 mol2·L-2。
(1)现向AgCl的悬浊液中:
①加入AgNO3固体,则Cl-的浓度________(填“变大”“变小”或“不变”,下同);
②若改加更多的AgCl固体,则[Ag+]__________;
③若改加更多的KBr固体,则[Ag+]_________,[Cl-]_________。
(2)有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是_______。
A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度,Ksp一定增大
B.两种难溶盐电解质,其中Ksp小的溶解度也一定小
C.难溶盐电解质的Ksp与温度有关
D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com