
【题目】20mL0.1000mol·L-1氨水用0.1000mol·L-1的盐酸滴定,滴定曲线如图,下列说法正确的是( )
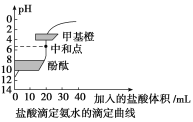
A.该中和滴定适宜用酚酞作指示剂
B.两者恰好中和时,溶液的pH=7
C.达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D.当滴入盐酸达30 mL时,溶液中c(NH4+)+c(H+)<c(OH-)+c(Cl-)
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | SO42-、OH- |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:
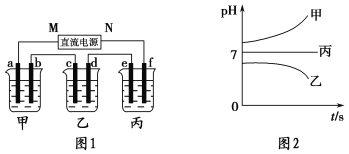
(1)M为直流电源的________极,b电极上发生的电极反应为______________________。
(2)计算e电极上生成的气体在标准状况下的体积为________________。
(3)写出乙烧杯中的总反应方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新能源的开发利用是人类社会可持续发展的必然选择。下列不属于新能源开发利用的是
|
|
|
|
A. 风力发电 | B. 锂电池供电 | C. 水力发电 | D. 太阳能供暖 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Ⅰ(英文名为Esmolol)是治疗快速室上性心律失常、急性心肌缺血、术后高血压等的理想药物,Esmolol的合成路线如图:

已知: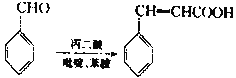
回答下列问题:
(1)C中官能团的名称有____。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。则有机物Ⅰ中的手性碳数目有____个。
(3)G→H的反应类型为____;B→C反应需要的试剂和条件为____。
(4)C→D中步骤①反应的化学方程式为_____。
(5)E的结构简式为____。
(6)X是F的同分异构体,则满足下列条件的X的结构有___种。
①能发生水解反应和银镜反应;
②能与FeCl3溶液发生显色反应,且苯环上有三个取代基。
(7)参照上述合成路线,设计以 、CH3OH和
、CH3OH和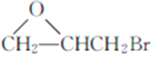 为主要原料制备
为主要原料制备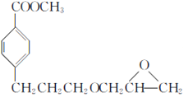 的合成路线。______
的合成路线。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室里需要氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案进行提纯:

已知:碳酸氢铵受热容易分解,生成二氧化碳、氨气和水。
(1)操作②能否改为加硝酸钡溶液,___(填“能”或“否”),理由___。
(2)进行操作②后,如何判断SO42-已除尽,方法是___。
Ⅱ.硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1:将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2:向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒
(2)在步骤3中,“一系列操作”依次为__、___和过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某太阳能电池的工作原理如图所示。下列说法正确的是

A. 光照时,b极的电极反应式为VO2+-e-+H2O=VO2++2H+
B. 光照时,毎转移2mol电子,有2mol H+由a极区经质子交换膜向b极区迁移
C. 夜间,a极的电极反应式为V3++e-=V2+
D. 硅太阳能电池供电原理与该电池相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入2滴酚酞试液。一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色。加热试管至水沸腾。发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色。关于该实验下列说法不正确的是
A. 温度越高,镁与水反应的速率越快
B. 镁与水反应的化学方程式为:Mg+2H2O = Mg(OH)2+H2↑
C. 氢氧化镁显碱性,且在水中有一定的溶解性
D. 氢氧化镁是离子化合物,它的电子式可表示为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) ![]() zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
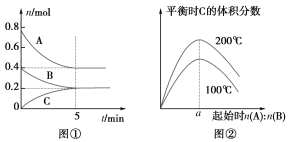
A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 由图②知反应xA(g)+yB(g) ![]() zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
C. 若在图①所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D. 200 ℃,6 min时向容器中充入2 mol A和1 mol B,重新达到平衡时,A的体积分数大于0.5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com