
分析 (1)研磨钙片应在研钵中进行;
(2)溶解钙片时加热可以加快溶解,硝酸易挥发,加热一段时间会除去硝酸;
(3)滴定时MnO4-转化为Mn2+,草酸被氧化为二氧化碳,结合电子守恒、电荷守恒、原子守恒配平书写离子方程式,滴定终点利用高锰酸钾溶液为紫红色判断,温度降低,反应速率减慢,滴定终点判断会提前,消耗标准溶液体积减小,据此判断测定结果;
(4)将①容量瓶中5mL溶液换成②容量瓶中5mL溶液,其余操作步骤同③,记录高锰酸钾标准溶液消耗的体积V2,目的是减小误差,做空白试验;
(5)重复操作③、④2-3次,取测定溶液体积的平均值计算.
解答 解:(1)实验室研磨钙片所用的仪器是研钵,
故答案为:研钵;
(2)溶解钙片时加热的作用是加快钙片的溶解速率,硝酸易挥发,继续加热溶液至2~3mL的目的是除去过量硝酸,
故答案为:加快钙片的溶解速率;除去过量硝酸;
(3)取①中定容后的溶液5mL,加入(NH4)2C2O4溶液,用氨水调节溶液pH使Ca2+完全沉淀.过滤,将CaC2O4沉淀溶于过量的稀H2SO4,生成草酸,滴定时MnO4-转化为Mn2+,草酸被氧化为二氧化碳,结合电子守恒、电荷守恒、原子守恒配平书写离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,滴定终点利用高锰酸钾溶液为紫红色判断,滴定终点的现象是:滴入最后一滴高锰酸钾溶液,溶液变成微红色且30 s不褪色,温度降低,反应速率减慢,滴定终点判断会提前,消耗标准溶液体积减小,导致测定结果偏低,
故答案为;2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;滴入最后一滴高锰酸钾溶液,溶液变成微红色且30 s不褪色;偏低;
(4)进行实验操作④的目的是减小误差,或空白试验,故答案为:减小误差(或空白实验);
(5)步骤⑤是重复操作③、④2-3次,取三次测定高锰酸钾溶液体积的平均值计算得到测定结果,
故答案为:重复操作③、④2~3次.
点评 本题考查了物质组成和测定,主要是滴定实验的分析判断、离子方程式书写、实验步骤的目的和完善,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,具有相同数目分子的气体必具有相同的体积 | |
| B. | 等质量的O2和H2的物质的量之比为16:1 | |
| C. | 不同的气体若体积不等,则它们所含的分子数一定不等 | |
| D. | 同温同体积下,两种气体的物质的量之比等于密度之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN易溶于水 | |
| B. | 氢氰酸溶液可以使pH试纸变红 | |
| C. | NaCN溶液显碱性 | |
| D. | 等物质的量的HCN与NaOH恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
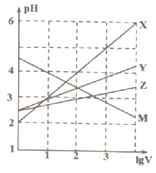 常温下取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3.且HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是( )
常温下取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3.且HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是( )| A. | X是HA,M是HB | |
| B. | 常温下pH:NaA溶液>NaB溶液 | |
| C. | 对于$\frac{c({R}^{-})}{c(HR)c(O{H}^{-})}$的值(R代表A或B),一定存在HA>HB | |
| D. | 若常温下浓度均为0.1mol/L的NaA和HA的混合溶液的pH>7,则c(A-)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 AsH3分子的VSEPR模型名称四面体结构,立体构型名称为三角锥,含有的共价键为极性键(极性键,非极性键),属于极性分子(极性分子,非极性分子),砷原子采取sp3杂化.
AsH3分子的VSEPR模型名称四面体结构,立体构型名称为三角锥,含有的共价键为极性键(极性键,非极性键),属于极性分子(极性分子,非极性分子),砷原子采取sp3杂化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成大量自然界不存在的新物质是现代化学的重要任务之一 | |
| B. | 现代的化工生产可以走“先污染,再治理”的发展路线 | |
| C. | 古人说的“以曾青涂铁,铁赤色如铜”属于物理变化 | |
| D. | 化学反应可以创造新的原子用于合成新的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
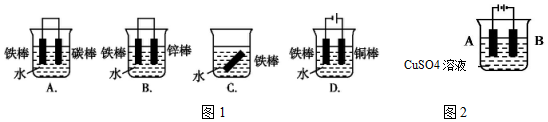
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
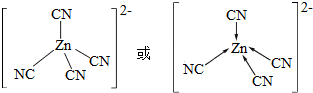 .
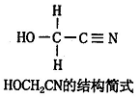
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com