
����Ŀ��ijҽҩ�м���F���Ʊ��������£����ֲ�������ȥ����
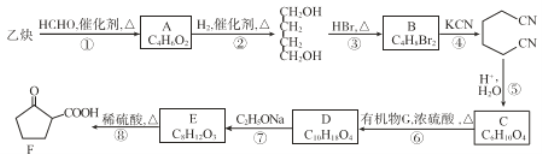
��֪�� ��R��R1��R2��R3��ʾ������
��R��R1��R2��R3��ʾ������
��1��F�к��й����ŵ��������ʻ���_____________��
��2����ʯ��CaC2����ˮ��Ӧ������Ȳ�Ļ�ѧ����ʽ��_____________��
��3��A���ܷ���������Ӧ����A�Ľṹ��ʽ��_____________��
��4����Ӧ��~���У����ڼӳɷ�Ӧ����_________������ţ���
��5����Ӧ�Ļ�ѧ����ʽ��_____________��
��6����Ӧ�ߵĻ�ѧ����ʽ��_____________��
��7��ij�ۺ���H�ĵ�����A��Ϊͬ���칹�壬�õ���˴Ź��������������壬�����֮��Ϊ1��2��3��������NaHCO3��Һ��Ӧ����ۺ���H�Ľṹ��ʽ��_____________��
��8��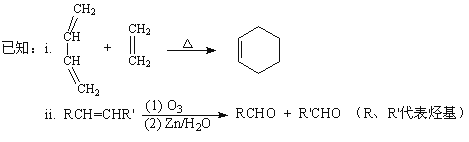 ����B��GΪ��ʼԭ�Ϻϳ�C��ѡ�ñ�Ҫ�����Լ���д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������_____________________________��
����B��GΪ��ʼԭ�Ϻϳ�C��ѡ�ñ�Ҫ�����Լ���д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������_____________________________��
���𰸡� �Ȼ� CaC2+2H2O = Ca(OH)2+C2H2�� HOCH2C![]() CCH2OH �ٺ͢�
CCH2OH �ٺ͢� 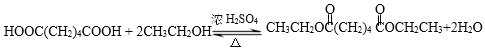
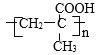

����������A�ķ���ʽ���Ʋ⣬��Ӧ��Ϊ2����HCHO��CH��CH��Ӧ����2HCHO+CH��CH��C4H6O2������ԭ���غ㣬�÷�ӦΪ�ӳɷ�Ӧ�����ݷ�Ӧ�ڵ�������������ƶϷ�Ӧ��ΪA��2����H2�����ӳɷ�Ӧ�����ݷ�Ӧ�۵�������B�Ľṹ��ʽ��֪��Ӧ��Ϊ����Ũ�������ȡ����Ӧ��BΪBrCH2CH2CH2CH2Br����Ӧ��Ϊ-CNȡ��-OH������C�ķ���ʽ���Ʋ⣬��Ӧ��Ϊ-CNת��Ϊ-COOH����CΪHOOC-CH2CH2CH2CH2-COOH�����ݷ�Ӧ���������ƲⷴӦ��Ϊ������Ӧ��D��C2H5ONa�������·�������֪��Ϣ���е�ȡ����Ӧ�����ò���EӦ����1���ʻ���1�����������ݷ�Ӧ���������F�Ľṹ��ʽ���ƶϣ���E��F��Ϊ����ˮ�⣬�ٽ��E�ķ���ʽ������EΪ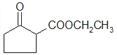 ��D��E������̼ԭ�ӣ���Ӧ�ߵ���һ����ΪCH3CH2OH�����ݡ���֪��Ϣ������DΪ��
��D��E������̼ԭ�ӣ���Ӧ�ߵ���һ����ΪCH3CH2OH�����ݡ���֪��Ϣ������DΪ��![]() ��
��
��1������F�Ľṹ��ʽ��֪F���й����ŵ�����Ϊ�ʻ����Ȼ���
��2��CaC2��ˮ��Ӧ��ʵ�����Ʊ�CH��CH��ԭ������ѧ����ʽΪCaC2+2H2O = Ca(OH)2+C2H2����
��3����������������Ӧ��Ϊ2����HCHO��CH��CH�����ӳɷ�Ӧ����A����A���ܷ���������Ӧ����A�в���ȩ�������ƶϷ�Ӧʱ�ϼ���ʽΪ������C=O������CH��CH�е�C-H��Hԭ�Ӽ���Oԭ���ϣ����μӳɵõ�2��-OH�������б���̼̼��������A�Ľṹ��ʽΪHOCH2C��CCH2OH��
��4�����������������ٺ͢����ڼӳɷ�Ӧ��
��5����Ӧ��ΪHOOC-CH2CH2CH2CH2-COOH��2����CH3CH2OH����������Ӧ����ѧ����ʽΪ��HOOC-CH2CH2CH2CH2-COOH + 2CH3CH2OH![]() CH3CH2OOC-(CH2)4-COOCH2CH3 + 2H2O��
CH3CH2OOC-(CH2)4-COOCH2CH3 + 2H2O��
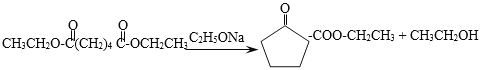
��6����Ӧ�߷���ʽΪ��![]()
![]()
 +CH3CH2OH��
+CH3CH2OH��
��7��AΪHOCH2C��CCH2OH��A�IJ����Ͷ�Ϊ2��H�ĵ�����A��Ϊͬ���칹�壬�õ�������NaHCO3��Һ��Ӧ����õ��庬��-COOH���Ȼ������Ͷ�Ϊ1���õ���ֻ����2����ԭ�ӣ��������۷�Ӧ��Ӧ�����Ӿ۷�Ӧ����H�����Ըõ��庬��̼̼˫�����÷��ӹ�6����ԭ�ӣ��������֮��Ϊ1��2��3����÷��Ӻ���1��-CH3�����Ʋ�õ���Ľṹ��ʽΪ��CH2=C(CH3)-COOH������H�Ľṹ��ʽΪ��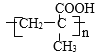 ��
��
��8����������������CΪHOOC-CH2CH2CH2CH2-COOH��C��2����CH3CH2OH����������Ӧ��������GΪCH3CH2OH��BΪBrCH2CH2CH2CH2Br������Ŀ������B��GΪԭ�Ϻϳ�C��B�к���4��̼ԭ�ӣ�G�к���2��̼ԭ�ӣ�C�к���6��̼ԭ�ӡ�������֪��Ϣi��������4��̼��ϩ����2��̼��ϩ����������Ӧi���õ���6��̼ԭ�ӵĻ���ϩ�������÷�Ӧii����̼̼˫�����ѵõ�����ȩ��Ȼ��ȩ�����ɵü����ᣬ��C���ʡ�BrCH2CH2CH2CH2Br��ͨ����ȥ��Ӧ�õ�1,3-����ϩ����Ӧ����ΪNaOH�Ĵ���Һ�����ȣ�CH3CH2OH����Ũ���ᡢ170��������·�����ȥ��Ӧ�õ�CH2=CH2����Ӧ���̿ɱ�ʾ���£�
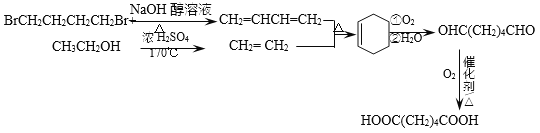


 �������ϵ�д�
�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A. ��NaCl��Һ��1��1ͨ��NH3��CO2�Ʊ�NaHCO3
B. 500�����ұ�ͨ��״���¸������ںϳɰ�
C. ʵ�����г����ű���ʳ��ˮ�ķ����ռ�����
D. ��ҵ����������Ĺ�����ʹ�ù����Ŀ�������߶��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦN2(g)��3H2(g) ![]() 2NH3(g)����H<0�����и����ʾ��ͼ�Ľ�����ͼ���������
2NH3(g)����H<0�����и����ʾ��ͼ�Ľ�����ͼ���������

A. ��ѹǿ�Է�Ӧ��Ӱ��(p2>p1) B. ���¶ȶԷ�Ӧ��Ӱ��
C. ��ƽ����ϵ����N2�Է�Ӧ��Ӱ�� D. �ܴ����Է�Ӧ��Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ��һ�ַ����Ժ��أ������ƶ���Ƥ�����������йظú���˵����ȷ����
��һ�ַ����Ժ��أ������ƶ���Ƥ�����������йظú���˵����ȷ����
A. ![]() ��Ħ��������32
��Ħ��������32
B. ![]() ��
��![]() ����Ϊͬλ��
����Ϊͬλ��
C. 1mol ![]() ��������ԼΪ32��6.02��1023
��������ԼΪ32��6.02��1023
D. �������������ж��������ڱ���λ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����DZ�ʾ������ɡ��ṹ�ͱ仯���ɵ�һ�־��й����ԡ���ѧ�Ժ淶�Ե��������ԣ���ѧ������м�㡢ȷ�еر��ﻯѧ֪ʶ�ͻ�ѧ��ѧ˼ά���ص㣮���л�ѧ��������д��ȷ���ǣ� ��
A. N2�ĵ���ʽ��![]()
B. ������Ľṹʽ��H-O-Cl
C. CO2���ӵı���ģ�� ��![]()
D. �õ���ʽ��ʾ�Ȼ�����ӵ��γɹ��̣�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼����Ҫ���������壬Ҳ��һ�ֹ�ҵԭ�ϡ�����̶������ã������ڻ�������ЧӦ�����Ļ������⡣
��1���ö�����̼�ϳɼ״���
��֪��2H2(g)��O2(g)��2H2O(g) ��H1����484 kJ/mol
2CH3OH(g) ��3O2(g)��2CO2(g)+4H2O(g) ��H2����1348 kJ/mol
�ڴ��������£�CO2��g����H2��g����Ӧ����CH3OH��g����H2O��g�����÷�Ӧ���Ȼ�ѧ����ʽ��________��
��2���ö�����̼�ϳɵ��ܶȾ���ϩ��LDPE����������������ĤΪ�����缫�����³�ѹ���CO2�����Ƶ�LDPE���õ缫��Ӧ���ܵĻ�������ͼ��ʾ��
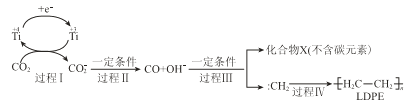
�� ���̢�~����̼Ԫ�ؾ�����________��Ӧ�����������ԭ������
�� CO2ת��ΪLDPE�ĵ缫��Ӧʽ�ǣ�������������ƽ��________
2n CO2 + ��________ +��________= ![]() + ��________��
+ ��________��
�۹�ҵ������1.4��104 kg ��LDPE����������Ҫ��״����CO2�������______L��
��3���ö�����̼�뻷������(![]() )��Ӧ�ϳɿɽ�������PPC��ͬʱҲ�����ɸ�����CPC���仯ѧ��Ӧ�����е������仯����ͼ��ʾ���ڲ�ͬ�¶Ⱥ�ѹǿ�£�PPC��ѡ���ԣ�������PPC������������������ı�ֵ�����ܲ��ʣ������������뷴Ӧ��Ͷ���������ı�ֵ�����±���ʾ��
)��Ӧ�ϳɿɽ�������PPC��ͬʱҲ�����ɸ�����CPC���仯ѧ��Ӧ�����е������仯����ͼ��ʾ���ڲ�ͬ�¶Ⱥ�ѹǿ�£�PPC��ѡ���ԣ�������PPC������������������ı�ֵ�����ܲ��ʣ������������뷴Ӧ��Ͷ���������ı�ֵ�����±���ʾ��

��ͨ���������ݢ������������Եó��Ľ�����________����25��ʱ��ʵ��������ѡ��ӦѹǿΪ1.5MPa��������2.0MPa��������________��
��ͨ���������ݢ�����������֪�¶�����ʹPPC��ѡ�����½��������ͼ˵����ԭ�������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��������������ʵ������ת�����ǣ� ��
A.Cl2��Cl��
B.H+��H2
C.MnO2��Mn2+
D.Zn��Zn2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ijЩ���������γ���Ӧ��������ʱ�����PHֵ���±���
�������� | Cu(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
0.1mol/L�Ľ������� ��ʼ����ʱPHֵ | 4.8 | 1.9 | 3.4 | 9.1 |
��ȫ������C�Q10-5��ʱPHֵ | 6.7 | 3.2 | 4.7 | 11.2 |
��1��ij����CuCl2��Һ�к���������FeCl3��Ϊ�õ��ϴ���CuCl2��2H2O���壬�ɼ���______________��������ҺPH ֵ��pH��4��ʹ��Һ�е�Fe3��ת��ΪFe(OH)3���������˺�������Һ����(���Ҫʵ�����) __________��_________���ɵ�CuCl2��2H2O���塣
��2�����ڿ�����ֱ�Ӽ���CuCl2��2H2O����ò���������ˮCuCl2����ԭ����______________________________________(�û�ѧ����ʽ��ʾ)������CuCl2��2H2O����õ�������ˮCuCl2�ĺ���������__________________________��(��д��Ҫ��ʵ�鲽������)
��3��ijѧϰС����һ��Ũ�ȵ�NaOH��Һ��Ϊ����ijЩ�������ӷ���ʱ��PH�����Լ���Ϊ����ȷ�ζ���Ũ�ȣ�������֪Ũ��0.200 mol/L�ı�������еζ�����ش�
��ȡ0.200 mol/L�ı��������ζ�ʱ�����²�������NaOHŨ��ƫС����______
A����ʼ�ζ�ʱ�ζ��ܼ��촦�������ݣ��ζ���������ʧ
B��ָʾ����ɫ��ֹͣ�ζ�����Һ�ֺܿ�(�������)�ָ�ԭɫ
C���ζ���ʼʱ���Ӷ������ζ��յ�ʱ���ӣ������������
D��ȡ�ü�Һǰ��ƿ������ˮϴ�Ӻ�δ��ɣ������������
��С������ͬѧ����һ���������������NaOH��ҺŨ����ȡ100.00 ml ����NaOH��Һ�����ڼ���0.200 mol/L�ı�����50.00 ml����ַ�Ӧ����������Һ�м����������ۣ��ռ�����״���µ�����67.2 ml�����ͬѧ�����ԭNaOH��Һ�ڳ����µ�PHֵΪ____________ (�������1λС������֪lg2��0.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪pC=-lgc��Ksp[Cu(OH)2]=2.2��10-20��Ksp[Mg(OH)2]=1.8��10-11��������ֽ������ӵ�PC��pH�ı仯��ϵ����ͼ��ʾ������˵����ȷ����
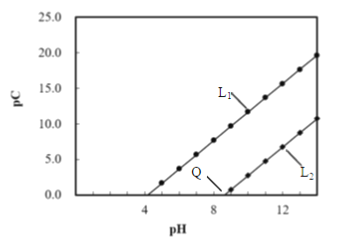
A. ���백ˮ����pH�ɳ�ȥMgS04��Һ�е�CuSO4����
B. pH����Q����Mg2+��Cu2+���ѳ�����ȫ
C. ��Ũ�Ⱦ�Ϊ1mo/LCuSO4��MgS04�Ļ����Һ�У�����c(Cu2+)+c(Mg2+)>c(S042-)
D. L1����pC(Cu2+)��pH�仯��L2����pC(Mg2+)��pH�仯
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com