
已知Q与R的摩尔质量之比为9:22,在反应X+2Y═2Q+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量 之比为()
之比为()
A. 46:9 B. 32:9 C. 23:9 D. 16:9
考点: 物质的量的相关计算;质量守恒定律.
专题: 计算题.
分析: 根据“反应X+2Y═2Q+R中,已知Q和R的相对分子质量之比为9:22”,则可假设Q和R的相对分子质量分别为9a、22a,依据Q、R的质量比以及1.6gX,生成4.4g R,代入计算,进而得到Y、Q的质量比.
解答: 解:可假设Q和R的相对分子质量分别为9a、22a,
设生成4.4gR需要Q的质量是x
X+2Y═2Q+R
18a 22a
x 4.4g
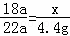 ,解得x=3.6g,
,解得x=3.6g,
由质量守恒可知参加反应的Y的质量为4.4g+3.6g﹣1.6g=6.4g,
所以参与反应的Y和生成物Q的质量之比为为6.4g:3.6g=16:9,
故选D.
点评: 本题考查学生利用化学反应方程式及质量守恒定律来计算物质的质量,明确相对分子质量与反应中物质的质量关系是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是()
A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1273K时发生反应Fe(s)+H2O(g)⇌FeO(s)+H2(g);现在固定容积为2.0L的密闭容器中进行该反应,试解答下列问题:
(1)其他条件不变,缩小该容器体积,反应速率增 (填“增大”、“减小”或“不变”)
(2)若降温后H2的百分含量减少,则正反应是 反应(选填“吸热”、“放热”).
(3)能判断该反应达到化学平衡状态的依据是 ;
a.混合气体的压强保持不变
b.H2的浓度不再改变
c.消耗H2O的物质的量与生成H2的物质的量之比为1:1
d.Fe、H2O、FeO、H2的物质的量之比为1:1:1:1.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于钠的说法正确的是()
A. 金属钠与少量氧气反应生成氧化钠,与足量氧气反应生成过氧化钠
B. 钠的化学 性质活泼,可从CuSO4溶液中置换出Cu
性质活泼,可从CuSO4溶液中置换出Cu
C. 钠着火时可以用沙土盖灭
D. 钠在空气中燃烧,产生黄色火花
查看答案和解析>>
科目:高中化学 来源: 题型:
据实验证明:用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好,原因可能是()
A. 漂白粉被氧化了
B. 有色布条被空气中的氧气氧化了
C. 漂白粉溶液跟空气中的CO2反应充分,生成了较多量的HClO
D. 漂白粉溶液蒸发掉部分水,其浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
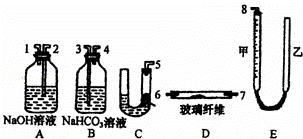
某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积.如图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水.甲管有刻度(0~50mL),供量气用;乙管可上下移动,以调节液面高低.
实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水试回答:(1)上述装置的连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略): .
(2)装置C中放入的反应物是 和 .
(3)装置A的作用是 ,装置B的作用是 .
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意 和 (填写字母编号).
a.视线与凹液面最低数相平b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平d.读数时不一定使甲、乙管液面相平.
查看答案和解析>>
科目:高中化学 来源: 题型:
C、N、S都是重要的非金属元素.下列说法正确的是()
A. 三者对应的氧化物均为酸性氧化物
B. 三者的单质直接与氧气反应都能至少生成两种氧化物
C. 相同温度下,等物质的量浓度的Na 2CO3、NaNO3、Na2SO3溶液的pH大小顺序:NaNO3<Na2S03<Na2CO3
2CO3、NaNO3、Na2SO3溶液的pH大小顺序:NaNO3<Na2S03<Na2CO3
D. CO2、NO2、SO2都能与H2O反应,其反应原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是实验室中制备气体或者验证气体性质的装置图

(1)写出用A制取氯气的化学方程式
(2)利用图中装置制备纯净、干燥的氯气,并证明氧化性:Cl2>Fe3+装置B中的溶液的作用为 ;
装置D中加的最佳试剂为(填序号) .
供选试剂:a、浓硫酸 b、FeCl2溶液 c、KSCN与FeCl2的混合溶液 d、无水氯化钙
(3)在如图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具有氧化性和漂白性:B中为少量Na2S溶液、C中为品红溶液,D中应加入足量的(填溶液名称),E中加入 溶液(填化学式)
(4)证明碳元素的非金属性比硅 元素的强的现象为 ,实验2不严谨之处应如何改进 .
元素的强的现象为 ,实验2不严谨之处应如何改进 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验基本操作或说法正确的是 (填写序号)
A、用50ml的量筒量取5.2ml稀硫酸
B、为了有效地除去粗盐中的Ca2+、Mg2+、SO42﹣,可先加入NaOH,再加入BaCl2,最后加入Na2CO3,将沉淀过滤后,再用HCl调整溶液至中性
C、石蕊试纸或PH试纸使用前都应用蒸馏水润湿
D、稀释浓硫酸时,应将水沿器壁缓缓加入浓硫酸中,并不断用玻璃棒搅拌
E、容量瓶中含有少量蒸馏水,对配制一定物质的量浓度的硫酸溶液无影响
F、将饱和FeC13溶液滴加沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体;
G、乙酸乙酯制备收集完毕,分液时,直接将乙酸乙酯从分液漏斗的上口倒出
H、在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com