
| A. | 实验剩余的药品不能放回原试剂瓶 | |
| B. | 滴管不能交叉使用 | |
| C. | 气体实验装置在实验前进行气密性检查 | |
| D. | 可燃性气体的验纯 |
分析 A.实验剩余药品一般不放回原试剂瓶,防止污染;
B.为防止药品变质,滴管不能交叉使用;
C.为防止装置漏气而导致实验失败,气体实验装置在实验前进行气密性检查;
D.可燃性气体不纯时,点燃易爆炸.
解答 解:A.实验剩余药品一般不放回原试剂瓶,防止污染,不是出于安全考虑,故A不选;
B.为防止药品变质,滴管不能交叉使用,不是出于实验安全考虑,故B不选;
C.为防止装置漏气而导致实验失败,气体实验装置在实验前进行气密性检查,不是出于实验安全考虑,故C不选;
D.可燃性气体不纯时,点燃易爆炸,出于实验安全考虑,故D选;
故选D.
点评 本题考查实验安全问题,题目难度不大,注意相关化学实验基本操作的注意事项的积累.


科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(PCl3)/mol | 4 | 2.8 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2) | B. | (1)(3) | C. | (1) | D. | (3)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盐酸酸化的Ba(NO3)2溶液中通入SO2,有白色沉淀生成,则BaSO3难溶于酸 | |
| B. | 液溴应保存在磨口玻璃塞的棕色细口试剂瓶中,并加少量水于液溴上层进行水封 | |
| C. | 向FeI2溶液中加入少量氯水,再加CCl4萃取,CCl4层呈紫红色,Fe2+的还原性强于I- | |
| D. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
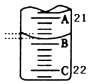 定量分析是化学实验中重要的组成部分.
定量分析是化学实验中重要的组成部分.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com