
| 1 |
| 3 |
| 1.75mol |
| 14mol |
| 1 |
| 3 |
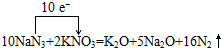 ,
,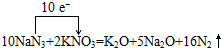 ;
;| 1 |
| 3 |
| 1.75mol |
| 14mol |
| 14.4g |
| 96g/mol |
| 0.15mol |
| 0.1L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚乙烯是纯净物 |
| B、光照条件下,2,2二甲基丙烷与Br2反应,其一溴代物只有一种 |
| C、苯酚俗称石炭酸,其水溶液呈弱酸性 |
| D、1溴丙烷和2溴丙烷分别与NaOH的乙醇溶液共热,所得产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当温度升高时,弱酸的电离平衡常数Ka变小 | ||
| B、常温下pH=3的乙酸溶液,c(H+)>c(OH-)>c(CH3COO-) | ||
| C、pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH>7 | ||
D、向0.1mol?L-1的醋酸溶液中加水或通入HCl气体能使
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大量燃烧化石燃料是造成雾霾天气的一种重要因素 |
| B、裂化汽油、花生油均能使溴的四氯化碳溶液褪色 |
| C、用聚乙烯塑料代替聚乳酸塑料可减少白色污染 |
| D、可用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
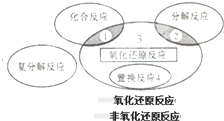
| A、①②③④ | B、⑤⑥⑦⑧ |
| C、①②③④⑧ | D、①③④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||||
B、2NaHCO3
| ||||
C、4NH3+5O2
| ||||
| D、Zn+H2SO=ZnSO4+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca(OH)2浊液与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| B、稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑ |
| C、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| D、大理石溶于醋酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com